FIBROMIALGIA: AL VIA IL PRIMO REGISTRO NAZIONALE DELLA SOCIETA’ ITALIANA DI REUMATOLOGIA (SIR)
AUTORI:
Fausto Salaffi, Sonia Farah
Clinica Reumatologica, Dipartimento Scienze Cliniche e Molecolari DISCLIMO, Università Politecnica delle Marche, Jesi (AN), Italy
Introduzione
La fibromialgia (FM) è definita come “una sindrome da sensibilizzazione centrale caratterizzata dalla disfunzione dei neurocircuiti preposti alla percezione, trasmissione e processazione delle afferenze nocicettive, con prevalente estrinsecazione del dolore a livello dell’apparato muscoloscheletrico”. Oltre al dolore possono essere presenti molteplici sintomi di accompagnamento, comuni ad altre sindromi algodisfunzionali (1). Tale sovrapposizione di segni e sintomi clinici con altre sindromi, quali il colon irritabile, i disturbi somatoformi, la cefalea muscolo-tensiva, la dismenorrea primaria, la sindrome da fatica cronica, la sindrome del colon irritabile, le algie faciali atipiche ecc. rendono, talvolta, difficile classificarla come un’entità clinica a sé stante. Sembra, tuttavia, corretto includere la FM nell’ambito delle “sindromi da sensibilizzazione centrale” (Figura 1) facendo riferimento, con questa definizione, al principale meccanismo patogenetico (alterazione del sistema nocicettivo) identificato come causa principale della sintomatologia, scheletrica ed extra-scheletrica.
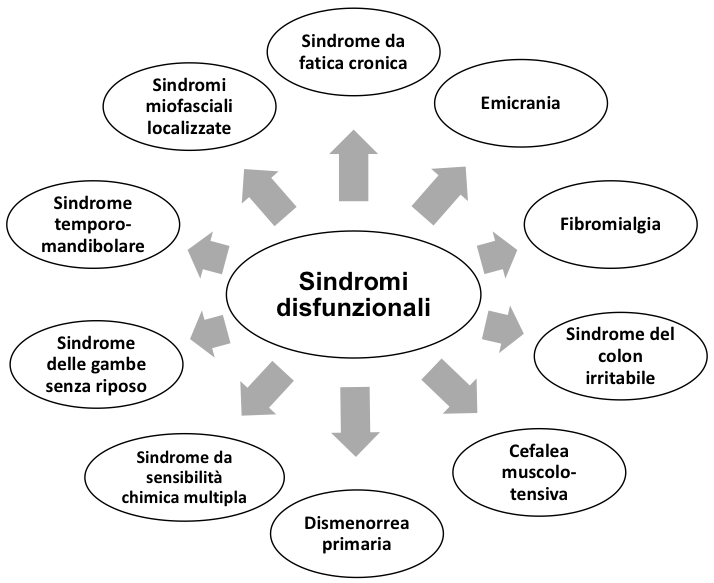
Figura 1. Principali sindromi da sensibilizzazione centrale
La FM occupa, per frequenza, il 2°-3° posto tra le malattie reumatiche e rappresenta il 12-20% delle diagnosi formulate in ambito ambulatoriale. La prevalenza riscontrata sulla popolazione generale è pari al 2,22%, che individuerebbe nel nostro Paese 1.346.700 pazienti affetti da FM (2). Sebbene l’eziologia della FM non sia del tutto nota, si ritiene che alla sua origine concorrano fattori esterni scatenanti, quali lo stress, altre malattie concomitanti ed una varietà di condizioni dolorose croniche diverse (3-7). La FM non presenta segni clinici obiettivi, ma piuttosto una serie di sintomi. I principali sono il dolore diffuso, la rigidità mattutina, l’affaticamento e l’astenia, il sonno non riposante, i disturbi intestinali/urogenitali, i disturbi del sistema nervoso centrale e neurocognitivi (Figura 2) (8). Questa proteiforme sintomatologia può essere modulata dalle variazioni atmosferiche e dalla temperatura. Nelle giornate fredde, umide e piovose il dolore e la rigidità sono più intensi, mentre la maggior parte dei pazienti riferisce un effetto benefico del caldo. L’inattività e l’iperattività aggravano la sintomatologia, che viene, invece, migliorata da una moderata attività fisica.
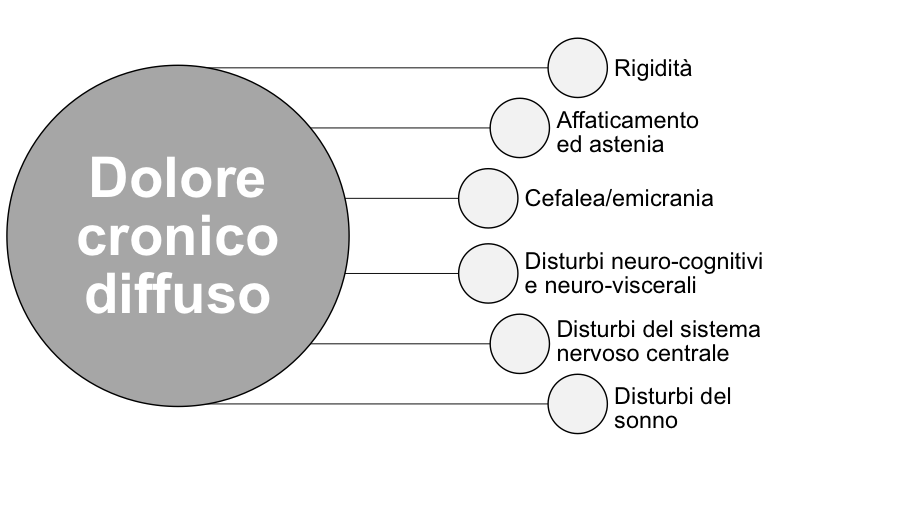
Figura 2: I principali sintomi della FM
Dolore cronico diffuso. Il dolore cronico diffuso che dura da almeno 3 mesi è il sintomo cardine della FM. Viene descritto dal paziente in maniera molto varia, come sensazione di bruciore, rigidità, tensione, come un crampo, un taglio, una scossa, una pugnalata, una bruciatura o la sensazione di essere contuso dappertutto. Causa disabilità al paziente, che, per diminuirne l’intensità, riduce le attività fisiche, quotidiane e lavorative, in casi estremi arrivando a provocare la completa immobilità del malato, il quale resta tutto il giorno seduto o a letto. Il paziente descrive il dolore con espressioni del tipo “mi fa male dappertutto”, oppure “ovunque mi si tocchi, sento male”. Si tratta di un dolore che non presenta una localizzazione ed un’entità costante, ma migra e può aumentare o diminuire durante l’arco della giornata. I pazienti percepiscono come dolorosi anche stimoli esterni solitamente innocui, come il tocco o indossare dei vestiti, hanno quindi allodinia (percezione di dolore a seguito di uno stimolo innocuo) ed iperalgesia (aumentata sensibilità al dolore, che si manifesta in caso di stimoli lievi). Può essere, inoltre, avvertito come bruciore, tensione, rigidità, sensazione di spilli. Solitamente, il dolore è aggravato dalla rigidità, dal freddo, umidità, ansia, stress, dal sovraccarico o dall’inattività, dal sonno non riposante e dal rumore. Queste caratteristiche sono quelle del “dolore centrale”, diverse da quelle di un “dolore periferico” di natura meccanica o infiammatoria, in cui sia la localizzazione che l’intensità sono molto più costanti (9).Tali caratteristiche e la frequente localizzazione al rachide (Figura 3) può rendere difficoltosa la diagnosi differenziale con il dolore infiammatorio, tipico dei pazienti affetti da spondiloartriti assiali, soprattutto tra le donne (7,8).
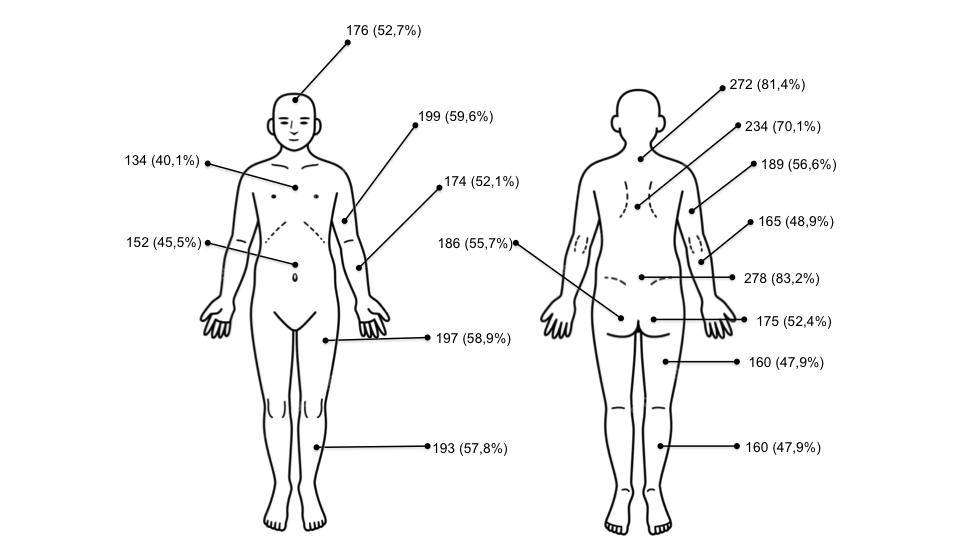
Figura 3: Localizzazione percentuale delle sedi dolorose nei pazienti con FM (8)
Rigidità. Il dolore si accompagna molto frequentemente a rigidità (84-91% dei casi), in genere di durata inferiore a 30 minuti, generalizzata o localizzata al tronco, che si presenta soprattutto al risveglio o in seguito al mantenimento prolungato della stessa posizione, ma anche la sera dopo una giornata lavorativa. Alcuni fattori esterni, come il microclima e l’umidità, possono peggiorarla.
Affaticamento ed astenia. L’affaticamento e l’astenia sono sintomi riferiti dal 75% al 90% dei pazienti con FM, che spesso possono divenire predominanti ed essere percepiti come prevalenti rispetto alla sintomatologia dolorosa. La ridotta resistenza alla fatica, la stanchezza e la debolezza possono aggravarsi fino all’estrema difficoltà a svolgere qualsiasi movimento (pazienti allettati). Le conseguenze rilevanti sono la forte difficoltà a compiere le normali attività quotidiane, ma interessano anche le sfere intellettuale, affettiva e psicologica. L’astenia dei pazienti con FM è del tutto simile a quella riscontrabile in una patologia denominata “sindrome da affaticamento cronico”, finora ritenuta una diversa entità. In realtà le due sindromi spesso si sovrappongono e può essere difficile distinguerle.
Cefalea/emicrania. La cefalea, soprattutto in sede nucale, muscolo-tensiva, ma anche quelle in sede temporale, sovraorbitaria, mascellare o mandibolare, oppure l’emicrania sono comuni nel paziente fibromialgico. Talora, il mal di testa è diffuso a tutto il cuoio capelluto, il cui semplice sfioramento riacutizza in maniera drammatica il dolore. La causa potrebbe essere riconducibile ad una condizione di spasmo muscolare a carico dei muscoli del collo e delle spalle. Nel 30-50% dei casi concomita una sindrome temporo-mandibolare.
Disturbi neurocognitivi. I disturbi cognitivi sono frequentemente presenti in pazienti affetti da FM ed includono la perdita della concentrazione e della capacità di fissare la memoria breve, il rallentamento nei gesti, l’incapacità di svolgere diverse mansioni contemporaneamente, la facile distrazione ed il sovraccarico cognitivo. Molto comuni sono “l’annebbiamento fibromialgico” (denominato fibro-fog) o la semplice sensazione di confusione, il peggioramento delle performance linguistiche, la dislessia quando il paziente è affaticato, la difficoltà di scrittura, di lettura e la matematica, etc. (10). Le funzioni cognitive dei pazienti con FM risultano peggiori rispetto a quelle di coetanei sani e simili a quelle di adulti venti anni più anziani, relativamente alla memoria a lungo termine e alla “memoria da lavoro” (working memory). L’aumentata attenzione per le sensazioni provenienti dal proprio corpo, il dolore, la presenza di parestesie/disestesie, descritte come sensazioni di formicolio, di spilli o aghi, la sonnolenza diurna ed il deficit di vigilanza secondari alle alterazioni del sonno e gli effetti indesiderati dei farmaci, sembrano essere la causa più probabile di questi disturbi.
Disturbi neuroviscerali. Sono comunemente osservabili nei pazienti con FM i disturbi gastrointestinali come difficoltà digestive, dolori addominali, alternanza di stipsi e diarrea, che si configurano nella “sindrome dell’intestino irritabile” (Irritable Bowel Syndrome, IBS). Alcuni pazienti riferiscono anche difficoltà di deglutizione, presumibilmente secondarie ad un’alterazione della funzionalità della muscolatura intrinseca dell’esofago. Sono riscontrabili, inoltre, disturbi urinari, come l’aumento della frequenza delle minzioni o l’urgenza minzionale, in assenza di infezioni delle vie urinari. Si tratta di sintomi tipici della cistite nella donna e dell’ipertrofia prostatica nell’uomo. Questi disturbi sono classificati come “sindrome della vescica irritabile”. In alcuni casi si può sviluppare una condizione dolorosa infiammatoria cronica della vescica conosciuta come “cistite interstiziale” (dolore, pressione, discomfort percepita a livello vescicale, associata a sintomi del basso tratto urinario). In aggiunta, nelle donne, è stata riscontrata una maggiore prevalenza di casi di disfunzione defecatoria dismenorrea e vulvodinia, condizione patologica definita da un dolore cronico localizzato nell’area vulvare, bruciore, fastidio e irritazione, che comporta difficoltà nei rapporti sessuali.
Disturbi dell’umore. I disturbi dell’umore quali ansia e depressione, ma anche ipocondria e attacchi di panico, sono presenti nel 60% dei pazienti con FM. La loro presenza ha indotto a interpretare la malattia come psicosomatica. In realtà soltanto 30-40% dei pazienti manifesta un disturbo psicologico significativo. Il più frequente è lo stato d’ansia, riportato nel 13 – 64% dei casi, ma numerose ricerche hanno escluso che la FM possa rappresentare una forma particolare di ipocondria. Spesso, concomita una “depressione secondaria”, reattiva allo scadimento generale dello stato di salute. La “catastrofizzazione” rappresenta un comune stile cognitivo presente in corso di FM, che comporta un’amplificazione esagerata degli aspetti emozionali, con una visione pessimistica, che fa considerare il dolore come intollerabile (11). È descritta una personalità fibromialgica, caratterizzata da alcuni tratti come perfezionismo, necessità di ordine e pianificazione, pulizia eccessiva, difficoltà a rilassarsi, iper-controllo della rabbia, bassa autostima, tendenza all’ipocondria, scarse capacità adattive, tendenza ad adottare il ruolo del malato, pessimismo. Tuttavia, non è agevole differenziare quali tra questi tratti possano considerarsi primari, pre-morbosi e favorenti l’insorgenza della malattia, e quali secondari alla presenza dei sintomi.
Disturbi del sonno. I disturbi del sonno sono pressochè costanti (80-90% dei casi) e comportano l’accentuazione, al momento del risveglio, del dolore e dell’astenia. Oltre alla difficoltà all’addormentamento, il paziente ha un sonno turbato da frequenti risvegli notturni e non ristoratore (12). Talora si associano alterazioni del sonno, quali la “sleep apnea” o la sindrome delle gambe senza riposo (oltre il 30% dei pazienti con FM ne soffre) che si manifesta come una necessità irrefrenabile di muovere continuamente le gambe; mentre in altri casi il movimento degli arti si verifica involontariamente durante il sonno (sindrome dei movimenti periodici degli arti durante il sonno).
Altri sintomi. Possono, inoltre, concomitare disturbi della sensibilità, soprattutto alla vista, al tatto, all’udito e all’olfatto e sono essenzialmente rappresentati da un’eccessiva sensibilità alle stimolazioni esterne, per cui stimoli solitamente ritenuti “confortevoli” possono essere avvertiti come particolarmente intensi. Gli annebbiamenti visivi, la difficoltà di messa a fuoco nello svolgimento di attività di precisione o durante la guida di autoveicoli, determinano, spesso, nausea e capogiri. I disturbi dell’equilibrio consistono in una sensazione d’instabilità, di barcollamento, soprattutto in condizione di stazione eretta prolungata. Le cause possono essere ricondotte a disturbi visivi, contrattura persistente della muscolatura del collo, ipotensione neuro-mediata caratterizzata da sensazione di svenimento, nausea, capogiro, annebbiamento visivo. Costanti sono i disturbi della percezione, quali parestesie a distribuzione non metamerica, sotto forma di formicolii diffusi a tutto il corpo o limitati a un emisoma o agli arti, sensazione di punture di aghi, d’intorpidimento o di “addormentamento” di un arto, sensazione di tumefazione delle mani e dei piedi, sensazioni anomale di freddo o di caldo intenso diffuse a tutto il corpo o agli arti. Talora, concomita un’alterata attività vasomotoria, che può aumentare tale disturbo e determinare arrossamento delle mani o vasospasmo da freddo sino a un vero e proprio fenomeno di Raynaud. Tale sintomo è di rilevante interesse poichè può indurre ad una diagnosi erronea (7). In alcuni pazienti vengono descritti sintomi “simil-connettivitici”, come la presenza di sindrome sicca (xerostomia e/o xeroftalmia). I fenomeni “allergici”, quali riniti, sinusiti, senso di congestione nasale e sintomi a carico delle basse vie respiratorie, sono riportati più frequentemente dai pazienti FM rispetto ai controlli, anche se, in realtà, si tratta, quasi sempre, di fenomeni di ipersensibilità scatenati da numerose sostanze presenti nell’ambiente quali il fumo di sigaretta, gli inquinanti ambientali, la polvere, i profumi. Quando le sostanze in grado di indurre queste reazioni sono molteplici, si parla di “Sindrome da Sensibilità Chimica Multipla” (Multiple Chemical Sensitivity – MCS). La MCS viene definita dal National Institute of Environmental Health Sciences statunitense come una malattia caratterizzata dalla impossibilità di tollerare un certo ambiente chimico o una classe di sostanze generalmente tollerate dalla popolazione sana. Il mercurio, il nichel, diversi pesticidi ed il silicone, utilizzato nelle protesi mammarie, sono le sostanze più frequentemente incriminate come possibile causa di MCS. Si tratta di una patologia tuttora controversa, strettamente connessa all’inquinamento ambientale che può condurre allo sviluppo di una condizione neurotossica strettamente embricata con i meccanismi algo-disfunzionali centrali e che può comportare svariati sintomi: respiratori, gastrointrestinali, endocrini, ginecologici, neurologici ed anche psichici. Secondo la Classificazione Internazionale la MCS è identificata con il codice ICD10 J68.9: “intolleranza a xenobiotici ambientali”, classificabile come “disturbo respiratorio non specificato in relazione all’esposizione ad agenti chimici, gas, fumi, vapori”.
Criteri diagnostici della Fibromialgia
È di intuibile importanza una diagnosi precoce per evitare, non solo l’aggravamento dei sintomi della FM, ma anche l’instaurarsi di circoli viziosi come dolore-disturbi dell’umore, dolore-immobilità, che ne rendono complessa la gestione. La combinazione delle numerose manifestazioni cliniche e la severità di ogni singolo sintomo presenta un’estrema variabilità da paziente a paziente. Ciò rende problematico il precoce riconoscimento della FM (13). Sebbene si tratti di una condizione clinica nota da tempo, solo recentemente ha ricevuto una definizione scientifica ed un riconoscimento formale. I primi criteri per la classificazione della FM sono stati proposti nel 1990 dall’American College of Rheumatology (ACR) (14) e nel 1992 l’Organizzazione Mondiale della Sanità ha riconosciuto la sindrome fibromialgica come patologia (Dichiarazione di Copenhagen), con l’inclusione nell’International Statistical Classification of Diseases and Related Health Problems (ICD) (gennaio 1993): codice “M79.0: Reumatismo non specifico”. Nella versione italiana dell’ICD-9-CM (anno 2007) la fibromialgia è classificata con il codice “729.0: Fibromialgia e reumatismi extraarticolari diffusi non specificati”. Inoltre, nel 2009 il Parlamento Europeo ha chiesto alla Commissione e al Consiglio di mettere a punto una strategia comunitaria per il suo riconoscimento come patologia, incoraggiare gli Stati membri a migliorare l’accesso alla diagnosi e ai trattamenti e promuovere la raccolta di dati. I criteri classificativi dell’ACR formulati nel 1990 (15) richiedono la presenza di dolore muscolo-scheletrico diffuso persistente da oltre tre mesi e la positività di almeno 11 dei 18 tender points (TPs), evocabili alla digitopressione indotta da una pressione di 4 kg/cm2 o mediante algometro a pressione posizionati in sedi codificate (Figura 4). Il dolore è considerato diffuso quando tutti i seguenti punti sono presenti: dolore nella parte sinistra del corpo, dolore nel lato destro del corpo, dolore sopra la vita, e il dolore sotto la vita, dolore scheletrico assiale (colonna cervicale o toracica anteriore o della colonna vertebrale toracica o lombare). Il dolore alla spalla e al gluteo è considerato per ogni lato coinvolto. Per lombalgia è considerato il dolore segmento inferiore. Il dolore diffuso deve essere presente da almeno 3 mesi. Questi criteri consentivano di porre diagnosi di FM, indipendentemente dalla presenza di altre patologie associate, con una sensibilità dell’88% e una specificità dell’81%.
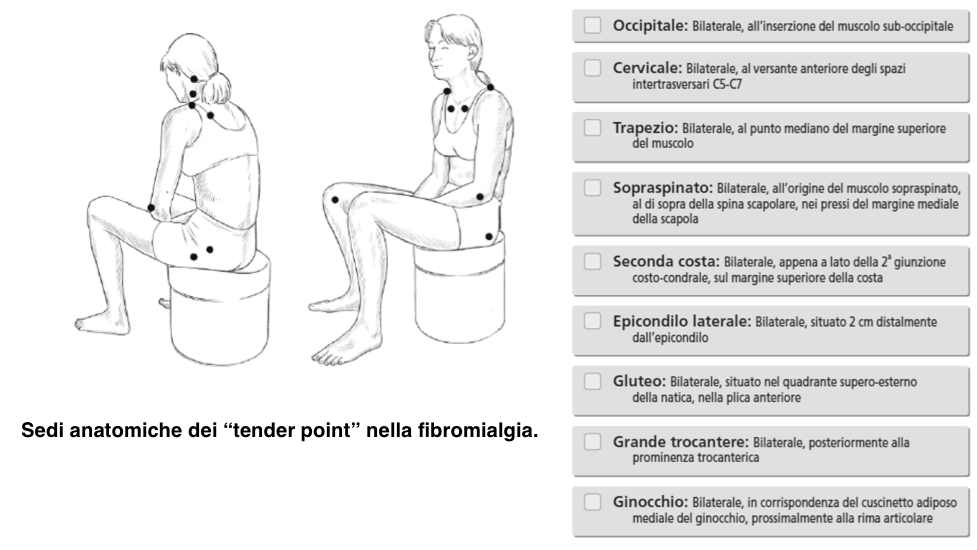
Figura 4. Sedi anatomiche dei “tender points” (15). La digitopressione deve essere effettuata con una forza approssimativa di 4 kg/cm2. Perchè un” tender point” sia considerato positivo il soggetto deve provare dolore alla digitopressione. La diagnosi di FM è soddisfatta se entrambi i criteri del dolore diffuso e della presenza di almeno 11/18 TPs sono soddisfatti. La presenza di un secondo disturbo clinico non esclude la diagnosi di FM.
Date le numerose perplessità sollevate da parte della comunità scientifica riguardo l’utilità di formulare la diagnosi di FM mediante la ricerca dei TPs, nel 2010, sono stati formulati dall’American College of Rheumatology (ACR), nuovi criteri classificativi (16). La valutazione del TPs, veniva spesso effettuata in maniera imprecisa o non corretta. La ricerca di questi punti, inoltre, richiede una certa manualità, per cui l’errata identificazione delle aree o l’applicazione di una forza eccessiva può condurre ad errori diagnostici. In alcuni casi, inoltre, i TPs sono confusi con i “punti trigger” (TrPs) caratteristici delle sindromi miofasciali localizzate. Inoltre, la soglia nocicettiva dei pazienti presenta variazioni anche in momenti diversi della stessa giornata, per cui nello stesso paziente il numero può risultare inferiore o superiore al numero richiesto per porre diagnosi a seconda del momento in cui viene esaminato. Non sempre, inoltre, i pazienti riferiscono dolore in tutti e quattro i quadranti corporei ed è presumibile che la metodica utilizzata per ricercare i TPs induca i soggetti particolarmente ansiosi a riferire precocemente una sensazione dolorosa. Inoltre, i criteri ACR 1990 non considerano altri sintomi come l’astenia, la rigidità, le alterazioni del sonno, dell’umore ed i sintomi neurologici presenti in oltre la metà dei pazienti. La constatazione che lo stesso paziente può rispettare i criteri per più sindromi differenti, ha indotto molti reumatologi a mettere in dubbio, non solo la specificità dei criteri ACR 1990, ma la stessa esistenza della FM come entità nosologica distinta (17). Pertanto, i nuovi criteri classificativi hanno proposto la combinazione delle seguenti due principali variabili (Widespread Pain Index-WPI) ed alla severità dei sintomi (Symptom Severity Score-SSS) (16):
Widespread Pain Index (WPI) o indice di dolore diffuso. Comprende una checklist di 19 zone del corpo e il paziente è invitato a contare le aree specifiche in cui ha sentito dolore nella settimana precedente la compilazione del questionario, attribuendo per ciascuna un punteggio pari a 1, con un punteggio totale compreso tra 0 e 19 (cingolo scapolare sinistro, cingolo scapolare destro, braccio sinistro, braccio destro, avambraccio sinistro, avambraccio destro, anca (gluteo trocantere) sinistra, anca (gluteo trocantere) destra, coscia sinistra, coscia destra, gamba sinistra, gamba destra, mascella destra, mascella sinistra, torace, area dorsale, area lombare, collo, addome).
Symptom Severity Score (SSS) o punteggio di severità dei sintomi. Il SSS ha origine dalla somma dei punteggi dei sintomi somatici, sonno non ristoratore, sintomi cognitivi, e stanchezza in una scala da 0-12. La scala SSS da sola fornisce una misura della gravità dei sintomi della FM. Per ognuno dei tre sintomi suddetti, viene indicato il grado di severità percepito dal paziente durante l’ultima settimana (Figura 5). Combinando la scala SSS ed il WPI si è giunti ad una nuova definizione di FM. Per soddisfare tali criteri classificativi il paziente deve rispondere alle 3 seguenti condizioni:
- Indice per il dolore diffuso (WPI) ≥7 e il punteggio della scala per la severità dei sintomi (SS) ≥5 o WPI 3-6 e punteggio della scala per la SS ≥9
- Sintomi presenti con la stessa intensità e persistenti da almeno 3 mesi
- Assenza di condizioni cliniche concomitanti che potrebbero spiegare in modo diverso il dolore.
La diagnosi clinica, sebbene più semplice, resta, tuttavia, basata essenzialmente sulla valutazione soggettiva del medico sull’entità e la severità dei sintomi somatici del paziente, non permettendo un’auto-valutazione dei sintomi da parte del paziente. Per tale ragione, nel 2011, è stata proposta una modifica dei criteri ACR 2010, in cui le aree del dolore e la presenza/assenza di 3 sintomi nella SSS (cefalea, dolore o crampi addominali e sintomi depressivi) vengono auto-valutati dal paziente (18). Una ulteriore modifica dei criteri 2010 è stata operata nel 2013, incrementando le aree di localizzazione del dolore, il numero di sintomi, migliorandone la specificità, indipendentemente dalla coesistenza di un’altra condizione dolorosa (19). È importante sottolineare, tuttavia, come sia i criteri 2010, che le versioni successive del 2011 e del 2013, pur essendo di più facile e veloce esecuzione, non prevedono il riscontro di segni clinici obiettivi, elemento imprescindibile nell’iter diagnostico di una patologia così complessa come la FM. Successivamente, nel 2016, è stata proposta una ulteriore revisione dei precedenti criteri da parte dell’ACR (20), basata sulla integrazione dei criteri formulati nel 2010 (physician-based) con i criteri autosomministrati (self-report) proposti e validati nel 2011. Secondo gli Autori i criteri physician-based sono validi per la diagnosi di FM nella pratica clinica, mentre i criteri self-report sono validi per la classificazione delle persone nell’ambito della ricerca scientifica, in particolare per studi epidemiologici, presentando, tra i vantaggi, quello di ridurre il carico di lavoro del medico nella raccolta delle informazioni. Secondo tale proposta (20), per la diagnosi di FM devono essere soddisfatti contemporaneamente 3 criteri:
- dolore diffuso in specifiche aree e regioni del corpo;
- presenza di sintomi caratteristici (astenia, sonno non ristoratore, problemi cognitivi, emicrania, dolore/crampi addominali, depressione) che compromettono la vita quotidiana;
durata della sintomatologia pari ad almeno 3 mesi
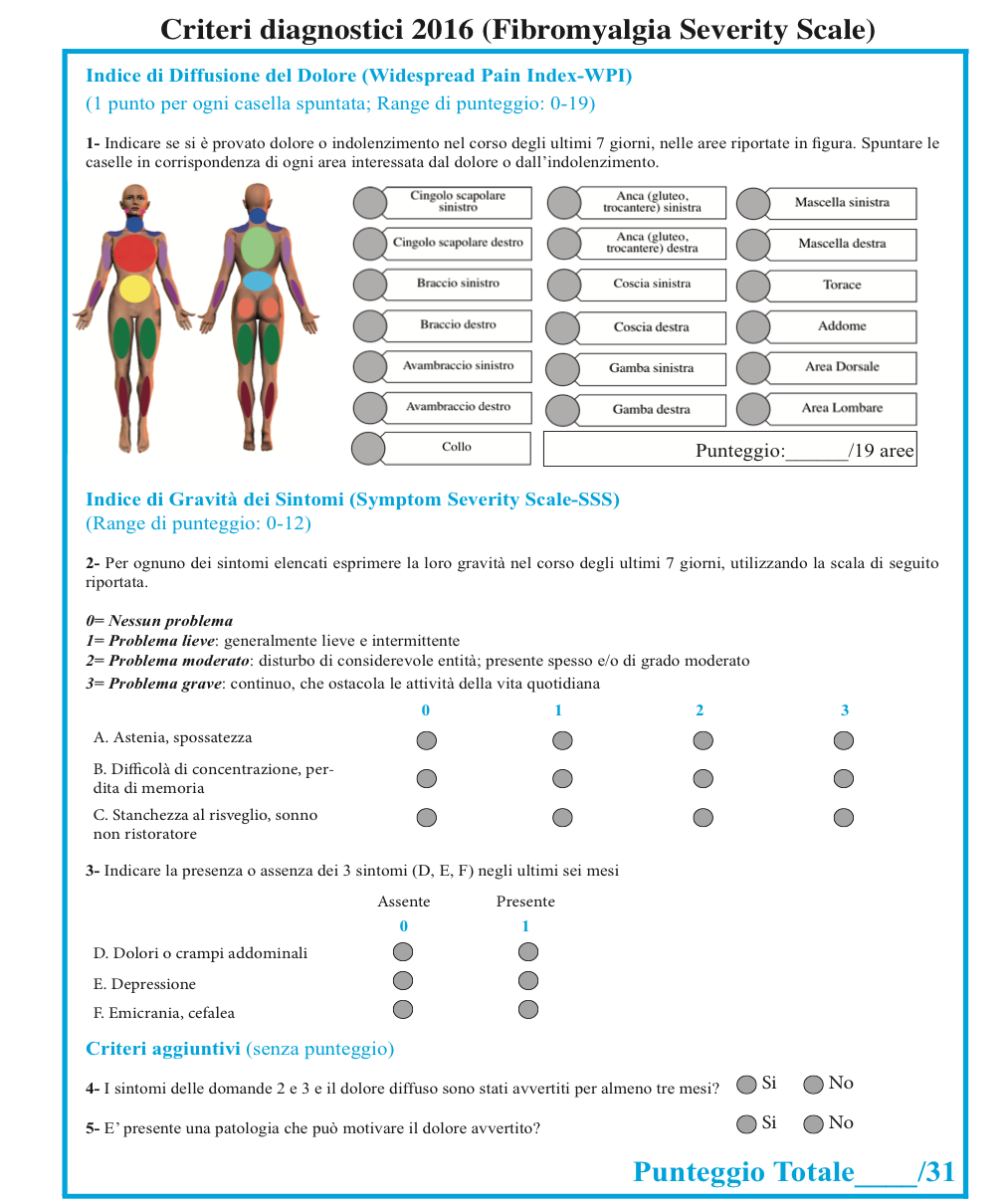
Figura 5. Criteri diagnostici proposti dall’American College of Rheumatology (ACR) del 2016 per la diagnosi di FM
Infine, grazie alla partnership tra l’ACTTION (Analgesic, Anesthetic, and Addiction Clinical Trial Translations Innovations Opportunities and Networks) con la Food and Drug Administration (FDA) statunitense e l’American Pain Society (APS) è stata avviata la ACTTION-APS Pain Taxonomy (AAPT) con l’intento di sviluppare criteri diagnostici semplificati per la FM (21). Tali criteri, come per i precedenti, sono esclusivamente basati sui sintomi clinici, non prevedono il conteggio dei TPs e richiedono la persistenza del dolore cronico (per almeno 3 mesi) in 6 o più aree corporee, delle 9 sedi individuate, in associazione alla coesistenza di moderati o severi disturbi del sonno o della fatica (Figura 6). Tali criteri vengono, tuttavia, ritenuti scarsamente performanti rispetto ai criteri formulati nel 2016 ed associati ad un elevato tasso di falsi positivi (22).
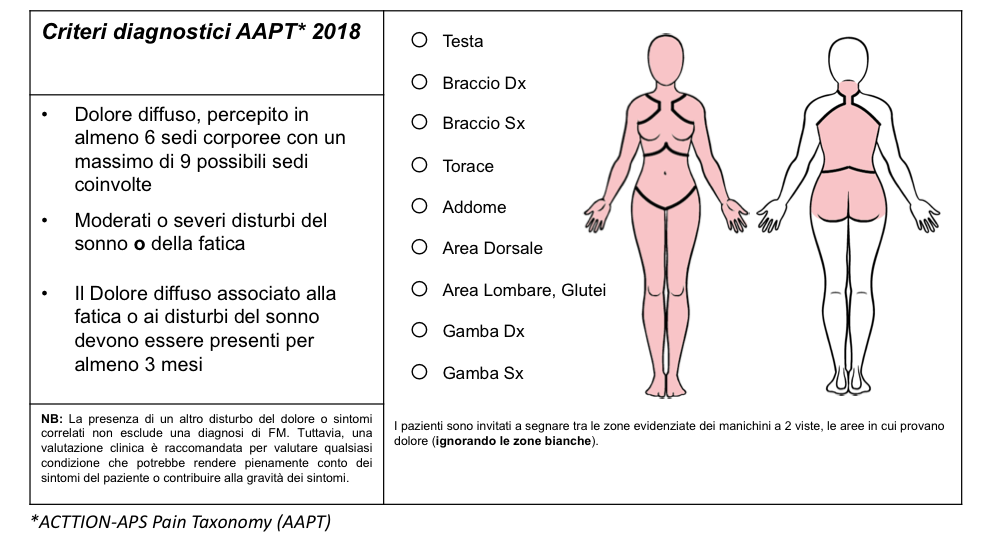
Figura 6: Criteri diagnostici semplificati proposti dall’ACTTION-APS Pain Taxonomy (AAPT) per la diagnosi di FM.
Livelli di severità di malattia
La varietà degli strumenti disponibili per la valutazione dei pazienti con FM e le proteiformi espressioni cliniche della malattia, rendono difficile la determinazione dello stato di severità di malattia e dell’efficacia dei diversi schemi terapeutici. La definizione dei livelli di severità della FM consente di stratificare differenti “cluster” di malattia, personalizzare l’intervento terapeutico ed attuare strategie di monitoraggio secondo le raccomandazioni Internazionali. Tali aspetti rientrano fra le principali priorità strategiche dell’Istituto Superiore della Sanità (ISS) e del Ministero della Salute in merito al riconoscimento della FM come malattia cronica ed alla definizione dei Livelli Essenziali di Assistenza (LEA). Uno dei problemi principali a tale riguardo è rappresentato dalla multifattorialità della sindrome, che induce necessariamente alla valutazione di outcomes primari e secondari “compositi”, che considerino non solo il sintomo dolore, ma anche altre manifestazioni quali il sonno, la fatica o stanchezza (fatigue) o di tipo socio-relazionali. In questo senso, una particolare attenzione deve essere posta al concetto di “stato di malattia” come attiva, o in parziale o totale remissione clinica, focalizzata su una pluralità di manifestazioni cliniche. L’Outcome Measures in Rheumatoid Arthritis Clinical Trials (OMERACT) FM working group, ha effettuato una revisione della letteratura sugli endpoints e sui relativi strumenti di misurazione impiegati nei trials randomizzati controllati (RCTs) e finalizzati a valutare l’efficacia di alcune strategie terapeutiche nella FM ed ha definito un insieme di domini di base da utilizzare, individuando quelli ritenuti clinicamente rilevanti. Molte delle scale e dei questionari segnalati come utili strumenti di misurazione, si sono rivelati troppo complessi e “time-consuming” per poter essere impiegati nell’attività clinica quotidiana, e per alcuni domini, la quantificazione e la valutazione della risposta terapeutica nel corso del follow-up (es. disturbo cognitivo) risulta particolarmente complessa. Gli strumenti più utili e performanti nella valutazione dell’impatto della FM sullo stato di salute e sulla qualità di vita, sono oggi rappresentati dalla versione modificata del Fibromyalgia Impact Questionnaire (FIQR) (23), dal FAS modificato (Fibromyalgia Assessment Status modified) (24) e dal Polysymptomatic Distress Scale – PDS) (25). Il FIQR comprende 21 items, strutturati su scale di valutazione numerica (NRS) comprese tra 0 e 10 (23). I quesiti vengono suddivisi in tre distinti domini: la funzione fisica (9 items), in relazione alla difficoltà di assolvere le comuni attività della vita quotidiana; lo stato di salute generale (2 items), che indaga l’impatto della malattia sullo svolgimento dell’attività lavorativa; la terza sezione prevede l’autovalutazione dell’intensità/gravità dei sintomi correlati alla malattia (10 items). Il FAS modificato prevede la valutazione della stanchezza e delle turbe del sonno (su scale numeriche da 0 a 10) e del numero delle aree dolenti. Il punteggio complessivo (compreso fra 0 e 39) è ottenuto dalla somma dei tre parametri (Figura 7) (24).
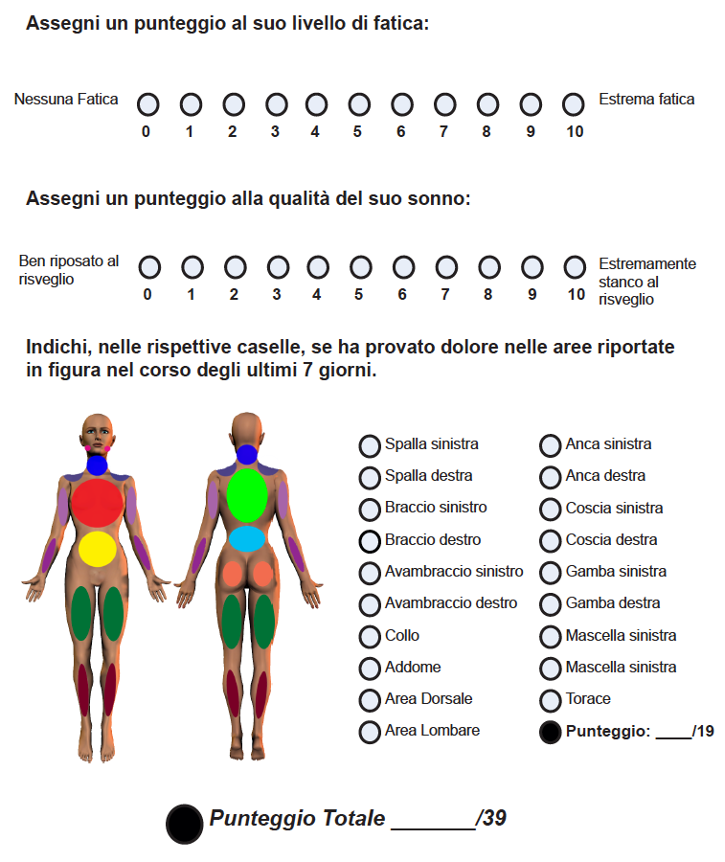
Figura 7: FAS modificato (Fibromyalgia Assessment Status modified) (24).
Il Fibromyalgia Severity Scale (noto anche come Polysymptomatic Distress Scale) (21), è calcolato dalla somma dei punteggi conseguiti da 2 sotto-indici:
- indice di diffusione del dolore (Widespread Pain Index -WPI)
- indice di gravità dei sintomi (Symptom Severity Scale-SSS).
Il punteggio finale dell’indice di diffusione del dolore (o WPI) corrisponde alla somma delle aree dolorose presenti (comprese da 0 a 19) (Figure 6 e 7). In aggiunta, il livello di diffusione del dolore viene misurato come regioni dolorose presenti (aggregato di aree) (da 0 a 5). Il punteggio massimo ottenibile è pari è 19. Il punteggio dell’indice di gravità dei sintomi corrisponde alla somma dei livelli di gravità di 3 sintomi (astenia, sonno non ristoratore, problemi cognitivi), misurati con una scala ordinale a 4 livelli (Figura 6):
- da 0 (nessun problema nella vita quotidiana) a 3 (gravi problemi nella vita quotidiana),
- alla presenza/assenza di altri 3 sintomi (emicrania, dolore / crampi addominali, depressione), misurati ognuno con una scala dicotomica compresa tra 0 (sintomo assente) e 1 (sintomo presente).
Il punteggio massimo ottenibile dalla scala di gravità dei sintomi è pertanto pari a 12.
Il Registro Nazionale della Fibromialgia
Per la prima volta il paziente è stato messo al “centro” per un nuovo, ambizioso e complesso progetto di Registro Nazionale (26). Questa iniziativa ha consentito di ottenere quella che è, ad oggi, la più ampia casistica italiana di pazienti affetti da FM. I dati epidemiologici e clinici ottenuti potranno ampliare la conoscenza della malattia, nella speranza di migliorarne il percorso diagnostico/terapeutico e favorire un approccio personalizzato. Uno studio collaborativo della SIR, con il patrocinio del Ministero della Salute, ha consentito, preliminarmente, di pervenire ad una definizione dei “cut-off” di severità della malattia, indispensabili all’inserimento della FM nell’elenco delle malattie croniche invalidanti (27, 28). Tale aspetto è ritenuto dalla Direzione Generale della Programmazione Sanitaria del Ministero della Salute, progetto strategico per l’aggiornamento dei LEA e la promozione dell’appropriatezza nella FM. Lo studio multicentrico (sono stati coinvolti 19 Centri Italiani di Reumatologia distribuiti su tutto il territorio Nazionale) (28), si è proposto l’obiettivo di consolidare su ampia casistica Nazionale precedenti osservazioni monocentriche (27) sui livelli di severità della malattia. L’analisi preliminare delle caratteristiche demografiche, cliniche e clinimetriche di 2339 pazienti reclutati, ha fornito risultati ed una serie di considerazioni riguardo la stratificazione dei livelli di severità di malattia a supporto della gestione razionale, sia del trattamento che della valutazione della progressione della malattia. In particolare sono stati determinati per ogni singolo strumento di valutazione (FIQR, FAS modificaco e PDS) i relativi livelli (valori soglia) di severità di malattia (Tabella 1).
Considerati questi risultati, si è resa necessaria la implementazione di un Registro Italiano dei pazienti con FM, realizzato con architettura “Web-based”, in grado di consentire l’organizzazione e l’ottimizzazione delle modalità di inserimento dei dati e rendere le informazioni tempestivamente accessibili, garantendo, al tempo stesso, la riservatezza e l’accesso ai dati solo ad utenti autorizzati (Figura 8). Tale necessità è fortemente sostenuta dall’ISS e dal Ministero della Sanità (DDL n. 299/18) e dalle numerose delibere regionali di Regione Marche (DGR 1555/18), Regione Emilia-Romagna (Circolare 5/02/2018) Regione Toscana (Allegato A Decisione Comitato Tecnico Scientifico n. 21 del 11/12/2018) Regione Friuli (LR n°13/2017). Si tratta, pertanto, di progetto strategico che la SIR ha ritenuto di supportare sia sul piano scientifico, che su quello economico, incaricando Hippocrates Sintech S.r.l dell’implementazione e della gestione informatizzata di tale Registro, sotto la coordinazione scientifica del Prof. Fausto Salaffi (Università Politecnica delle Marche, Ancona).
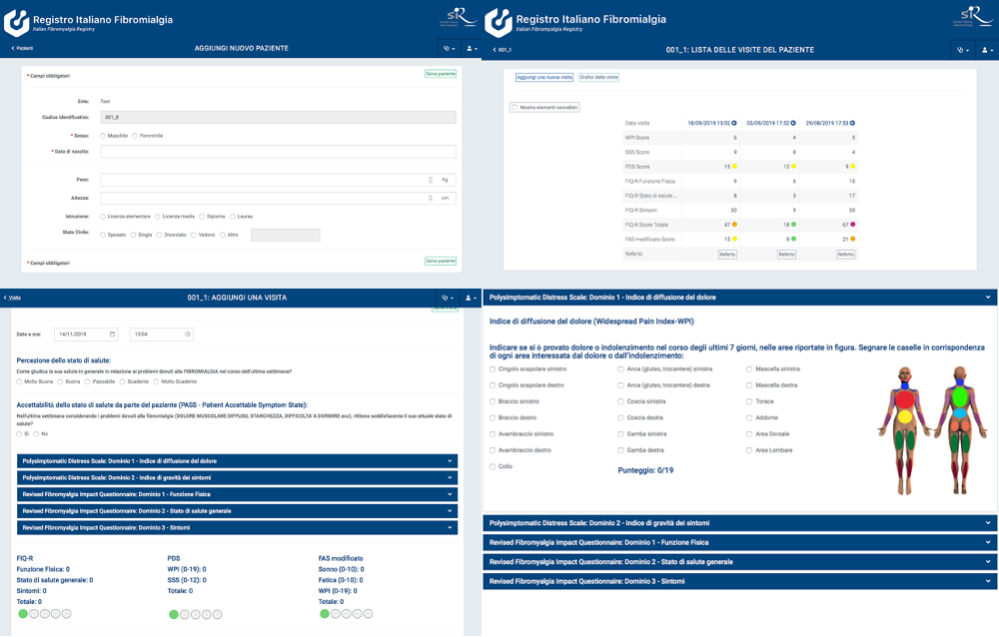
Figura 8: Il Registro Italiano per la FM. Il registro permette l’ottimizzazione delle modalità di inserimento dei dati clinici rendendoli tempestivamente accessibili e garantendo riservatezza e sicurezza.
Grazie al registro, che ha visto, ad ora, la partecipazione attiva di 42 Centri di Reumatologia sul territorio nazionale (Figura 9), sarà possibile misurare il grado di severità, migliorare la conoscenza della storia naturale della malattia, definire l’intervallo di tempo tra l’esordio dei sintoni e la diagnosi, monitorare ed aggiornare il percorso diagnostico-terapeutico-assistenziale (PDTA) e valutare gli esiti e l’impatto socio/economico.
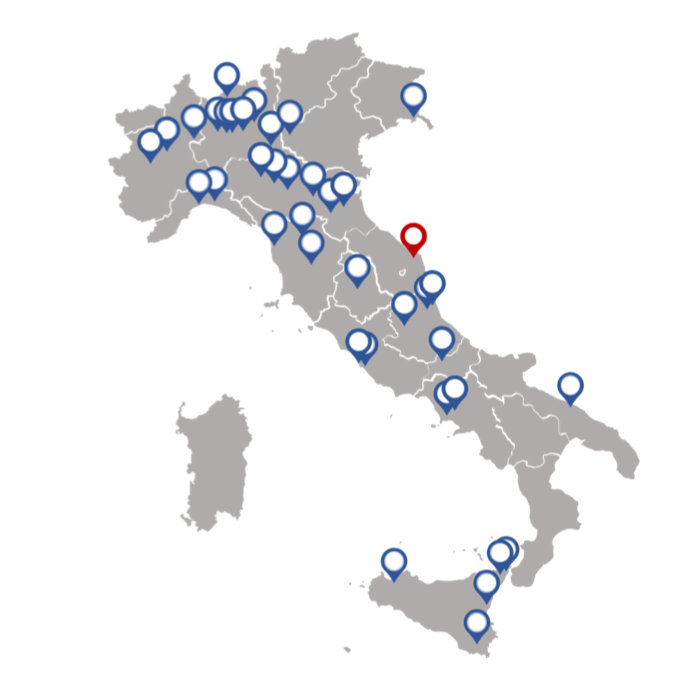
Figura 9. Centri Italiani di Reumatologia aderenti al progetto “Registro Italiano della Fibromialgia”
La piattaforma è stata progettata e realizzata per consentirne un utilizzo esclusivamente in “rete”, attraverso un collegamento sicuro ad Internet (la disponibilità di un accesso Internet è demandata ai Centri aderenti al Registro fruitori della applicazione) tramite dominio dedicato, dal quale i servizi del Registro saranno accessibili agli utenti, preventivamente autorizzati da SIR, tramite la presentazione di apposite credenziali rilasciate dagli amministratori della piattaforma: Login e Password. Le regole vigenti eliminano, virtualmente, la possibilità che un utente non autorizzato acceda al sistema. La password in chiaro non verrà mai salvata nel sistema. La password viene archiviata tramite un codice di “hash” a una via e verificata utilizzando lo stesso codice a ogni login. Nessuno presso la società che ha realizzato il software può conoscere tale password. Se un utente dovesse dimenticare la password, il recupero avverrà tramite un controllo via mail. Tutte le comunicazioni tra l’utente e il server della piattaforma sono protette tramite SSL AES 256-bit, uno dei più elevati livelli di crittografia attualmente disponibili. Viene utilizzato lo standard la porta SSH per l’amministrazione remota, anch’esso su protocollo sicuro.
Prima dell’arruolamento nello studio, ogni singolo paziente fornisce la propria adesione mediante consenso informato. Viene registrato sul database data, ora e IP del dispositivo dal quale è stato dato il consenso. In mancanza di consenso, non è possibile accedere ai servizi (da parte dell’operatore o del paziente). Le autorizzazioni ed il consenso potranno essere revocati in qualunque momento. Tutti i pazienti reclutati vengono sottoposti a valutazione clinica ed anamnestica da parte del medico investigatore. In particolare sono raccolte le seguenti informazioni:
- Dati Anagrafici (con gestione della anonimizzazione pazienti in aderenza alle normative regolatorie e sulla base delle modalità di raccolta dati del registro);
- Misure antropometriche (peso, altezza, BMI);
- Comorbidità;
- Terapie farmacologiche e non farmacologiche;
- Criteri classificativi della fibromyalgia (criteri ACR);
- Valutazione degli outcomes (versione italiana del Revised Fibromyalgia Impact Questionnaire – FIQR, Patient Accettable Symptom Scale – PASS, Short Form Health Survey – SF36, Widespread Pain Index – WPI, Symptom Severity Scale – SSS, Polysymptomatic Distress Scale – PDS).
Sarà, inoltre, consentita alle Regioni la possibilità di accedere alla funzione di “cruscotto analitico” e l’export selettivo dei dati clinici e demografici in formato XLS. Ovvero di funzioni in grado di presentare in tempo reale (solo per i coordinatori del registro) le statistiche relative ai dati raccolti, di filtrarle per chiavi di ricerca e di esportarle in formato Excel. I dati scambiati tra il Centro reumatologico e il Database Centrale, verranno crittografati grazie ad opportune metodologie, rendendo ogni trasmissione dati sicura e protetta da tentativi di intromissione, anche tramite l’adozione di certificato di sicurezza HTTPS. La piattaforma utilizza un certificato digitale emesso da uno dei principali Certification Authority Server.
Bibliografia
- Talotta R, Atzeni F, Bazzichi L, Giacomelli C, Di Franco M, Salaffi F, Sarzi-Puttini P. Algo-dysfunctional syndromes: a critical digest of the recent literature. Clin Exp Rheumatol. 2015;33(1 Suppl 88):S102-8.
- Salaffi F, De Angelis R, Grassi W; MArche Pain Prevalence; INvestigation Group (MAPPING) study. Prevalence of musculoskeletal conditions in an Italian population sample: results of a regional community-based study. The MAPPING study. Clin Exp Rheumatol. 2005;23(6):819-28.
- Stisi S, Cazzola M, Buskila D, Spath M, Giamberardino MA, Sarzi-Puttini P, Arioli G, Alciati A, Leardini G, Gorla R, Marsico A, Ceccherelli F, Bazzichi L, Carignola R, Gracely RH, Salaffi F, Marinangeli F, Torta R, Di Franco M, Biasi G, Cassisi G, Casale R, Altomonte L, Atzeni F; Italian Fibromyalgia Network. Etiopathogenetic mechanisms of fibromyalgia syndrome. Reumatismo. 2008;60 Suppl 1:25-35
- Salaffi F, Atzeni F, Talotta R, Di Carlo M, Sarzi-Puttini P. Earthquake vulnerability of fibromyalgia patients: six-month follow-up after the catastrophic disasters in central Italy. Clin Exp Rheumatol. 2017;35 Suppl 105(3):93-99.
- Ferraccioli G, Cavalieri F, Salaffi F, Fontana S, Scita F, Nolli M, Maestri D. Neuroendocrinologic findings in primary fibromyalgia (soft tissue chronic pain syndrome) and in other chronic rheumatic conditions (rheumatoid arthritis, low back pain). J Rheumatol. 1990;17(7):869-73.
- Atzeni F, Cazzola M, Benucci M, Di Franco M, Salaffi F, Sarzi-Puttini P. Chronic widespread pain in the spectrum of rheumatological diseases. Best Pract Res Clin Rheumatol. 2011;25(2):165-71.
- Di Franco M, Iannuccelli C, Bazzichi L, Atzeni F, Consensi A, Salaffi F, Pietropaolo M, Alessandri C, Basili S, Olivieri M, Bombardieri S, Valesini G, Sarzi-Puttini P. Misdiagnosis in fibromyalgia: a multicentre study. Clin Exp Rheumatol. 2011;29(6 Suppl 69):S104-8.
- Salaffi F, Mozzani F, Draghessi A, Atzeni F, Catellani R, Ciapetti A, Di Carlo M, Sarzi-Puttini P. Identifying the symptom and functional domains in patients with fibromyalgia: results of a cross-sectional Internet-based survey in Italy. J Pain Res. 2016;9:279-86.
- Salaffi F, Giacobazzi G, Di Carlo M. Chronic Pain in Inflammatory Arthritis: Mechanisms, Metrology, and Emerging Targets-A Focus on the JAK-STAT Pathway. Pain Res Manag. 2018,7;2018:8564215.
- Torta RG, Tesio V, Ieraci V, Castelli L, Zizzi FB. Fibro-fog. Clin Exp Rheumatol. 2016;34(2 Suppl 96):S6-8.
- Lee J, Protsenko E, Lazaridou A, Franceschelli O, Ellingsen DM, Mawla I, Isenburg K, Berry MP, Galenkamp L, Loggia ML, Wasan AD, Edwards RR, Napadow V. Encoding of Self-Referential Pain Catastrophizing in the Posterior Cingulate Cortex in Fibromyalgia. Arthritis Rheumatol. 2018;70(8):1308-1318.
- Choy EH. The role of sleep in pain and fibromyalgia. Nat Rev Rheumatol. 2015;11(9):513-20.
- Bennett RM, Russell J, Cappelleri JC, Bushmakin AG, Zlateva G, Sadosky A. Identification of symptom and functional domains that fibromyalgia patients would like to see improved: a cluster analysis. BMC Musculoskelet Disord 2010;11:134.
- Salaffi F, Sarzi-Puttini P. Old and new criteria for the classification and diagnosis of fibromyalgia: comparison and evaluation. Clin Exp Rheumatol. 2012;30(6 Suppl 74):3-9.
- Wolfe F, Smythe HA, Yunus MB, et al. The American College of Rheumatology (ACR) 1990 criteria for classification of fibromyalgia. Arthritis Rheum 1990;33:160-72.
- Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Katz RS, Mease P, Russell AS, Russell IJ, Winfield JB, Yunus MB. The American College of Rheumatology preliminary diagnostic criteria for fibromyalgia and measurement of symptom severity. Arthritis Care Res (Hoboken). 2010;62(5):600-10.
- Sarzi-Puttini P, Atzeni F, Masala IF, Salaffi F, Chapman J, Choy E. Are the ACR 2010 diagnostic criteria for fibromyalgia better than the 1990 criteria? Autoimmun Rev. 2018;17(1):33-35.
- Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Hauser W, Katz RS, et al. Fibromyalgia criteria and severity scales for clinical and epidemiological studies: a modification of the ACR preliminary diagnostic criteria for fibromyalgia. J Rheumatol 2011;38:1113–22.
- Bennett RM, Friend R, Marcus D, Bernstein C, Han BK, Yachoui R et al. Criteria for the diagnosis of fibromyalgia: validation of the modified 2010 preliminary American College of Rheumatology criteria and the development of alternative criteria. Arthritis Care Res 2014; 66(9):1364-73.
- Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Häuser W, Katz RL, Mease PJ, Russell AS, Russell IJ, Walitt B. 2016 Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Semin Arthritis Rheum. 2016;46(3):319-329.
- Arnold LM, Bennett RM, Crofford LJ, Dean LE, Clauw DJ, Goldenberg DL, Fitzcharles MA, Paiva ES, Staud R, Sarzi-Puttini P, Buskila D, Macfarlane GJ. AAPT Diagnostic Criteria for Fibromyalgia. J Pain. 2019;20(6):611-628.
- Wolfe F. Letter to the editor, “Fibromyalgia Criteria”. J Pain. 2019 Feb 11. pii: S1526-5900(18)30920-9. doi: 10.1016/j.jpain.2019.02.002.
- Salaffi F, Franchignoni F, Giordano A, Ciapetti A, Sarzi-Puttini P, Ottonello M. Psychometric characteristics of the Italian version of the revised Fibromyalgia Impact Questionnaire using classical test theory and Rasch analysis. Clin Exp Rheumatol. 2013 Nov-Dec;31(6 Suppl 79):S41-9.
- Salaffi F, Di Carlo M, Farah S, Atzeni F, Buskila D, Ablin JN, Häuser W, Sarzi-Puttini P. Diagnosis of fibromyalgia: comparison of the 2011/2016 ACR and AAPT criteria and validation of the modified Fibromyalgia Assessment Status. Rheumatology (Oxford). 2020, 1;59(10):3042-3049.
- Wolfe F, Walitt BT, Rasker JJ, Katz RS, Häuser W. The Use of Polysymptomatic Distress Categories in the Evaluation of Fibromyalgia (FM) and FM Severity. J Rheumatol. 2015;42(8):1494-501.
- Salaffi F, Farah S, Di Carlo M, Sinigaglia L, Galeazzi M, Gerli R, Sonnati M, Giorgi V, Sarzi-Puttini P, Masullo M; Italian Society of Rheumatology (SIR) and Ministero della Salute – Direzione Generale della Programmazione Sanitaria, Roma, Italy. The Italian Fibromyalgia Registry: a new way of using routine real-world data concerning patient-reported disease status in healthcare research and clinical practice. Clin Exp Rheumatol. 2020;38 Suppl 123(1):65-71.
- Salaffi F, Di Carlo M, Arcà S, Galeazzi M. Categorisation of disease severity states in fibromyalgia: a first step to support decision-making in health care policy. Clin Exp Rheumatol. 2018;36(6):1074-1081.
- Salaffi F, Di Carlo M, Bazzichi L, Atzeni F, Govoni M, Biasi G, Di Franco M, Mozzani F, Gremese E, Dagna L, Batticciotto A, Fischetti F, Giacomelli R, Guiducci S, Guggino G, Bentivegna M, Gerli R, Salvarani C, Bajocchi G, Ghini M, Iannone F, Giorgi V, Farah S, Cirillo M, Bonazza S, Barbagli S, Gioia C, Santilli D, Capacci A, Cavalli G, Carubbi F, Nacci F, Riccucci I, Sinigaglia L, Masullo M, Polizzi BM, Cutolo M, Sarzi-Puttini P. Definition of fibromyalgia severity: findings from a cross-sectional survey of 2339 Italian patients. Rheumatology (Oxford). 2020, 13:keaa355. doi: 10.1093/rheumatology/keaa355.
