UTILITÀ CLINICA E POTENZIALITÀ DELL’ECOGRAFIA NELL’OSTEOARTROSI
AUTORI:
1Marco Di Carlo,2Tadashi Okano,2Kenji Mamoto,1Fausto Salaffi
1Clinica Reumatologica, Università Politecnica delle Marche, Ospedale ”C. Urbani”’, Jesi (Ancona), Italia
2Dipartimento di Chirurgia Ortopedica, Osaka City University Graduate School of Medicine, Osaka, Giappone
Introduzione
L’osteoartrosi (OA) è la patologia più comune delle articolazioni umane. L’OA genera dolore muscoloscheletrico cronico e disabilità motoria, specialmente nelle persone anziane. L’OA di ginocchio o di anca ha una prevalenza del 40% nelle persone di età superiore ai 65 anni nei paesi occidentali, ed il sintomo dolore è la principale caratteristica dell’OA che determina disabilità (ad esempio, difficoltà a camminare e salire le scale) (Dawson J, et al. Rheumatology (Oxford) 2004). Poter individuare le espressioni precoci di OA può permettere di curare la malattia tempestivamente.
Negli ultimi anni le tecniche di imaging hanno auto un importante sviluppo nell’ambito della patologia artrosica (Roemer FW, et al. Best Pract Res Clin Rheumatol 2014). La radiografia convenzionale rimane la tecnica più diffusamente utilizzata per la diagnosi di OA. Attraverso una semplice radiografia è possibile determinare la due parametri fondamentali come la riduzione della rima articolare e le dimensioni degli osteofiti. Su questi due rilievi si basa il punteggio di Kellgren-Lawrence, un indice composito che permette di valutare la gravità dell’OA (Kellgren JH, et al. Ann Rheum Dis 1957).
Valutare la riduzione della rima articolare rappresenta il “gold standard” nella pratica quotidiana nello stabilire la severità dell’OA, raccomandato inoltre come miglior metodo disponibile per indagare la progressione del danno articolare (Reichmann WM, et al. Osteoarthritis Cartilage 2011). Tuttavia, la radiografia convenzionale non è sensibile alle alterazioni degenerative cartilaginee precoci, che si verificano già prima del rilievo radiografico di riduzione della rima articolare e della presenza di osteofiti, alterazioni strutturali che appaiono solo negli stadi relativamente tardivi dell’OA (Wang Y, et al. Ther Adv Musculoskelet Dis 2012; Guermazi A, et al. Rheum Dis Clin North Am 2013). Attualmente esistono sistemi di scoring diversi dal Kellgren-Lawrence, come quello dell’Osteoarthritis Research Society International, in cui è fatta un’analisi compartimentale dei rilievi patologici (Altman RD, et al. Osteoarthritis Cartilage 2007). La riduzione della rima articolare continua ad essere ampiamente applicata come indicatore indiretto di assottigliamento della cartilagine tibio-femorale. Tuttavia, la riduzione della rima articolare radiografica riflette l’assottigliamento della cartilagine e l’estrusione meniscale, non mostrando i danni morfologici cartilaginei e meniscali (Amin S, et al. Arthritis Rheum 2005; Hunter DJ, et al. Arthritis Rheum 2006).
Un’altra tecnica di imaging che ha acquisito molta importanza nell’ambito dell’OA è la risonanza magnetica per immagini (RM). La RM viene utilizzata sempre più spesso per visualizzare direttamente la cartilagine e le strutture intra-articolari. La RM è il gold standard per la valutazione dell’articolazione di ginocchio ed è considerata la tecnica di imaging più accurata per la valutazione dell’OA del ginocchio (Roemer FW, et al. Best Pract Res Clin Rheumatol 2014; Stammberger T, et al. Magn Reson Med 1999). I vantaggi della RM includono la non invasività, la possibilità di ricostruzioni multiplanari e l’eccellente risoluzione di contrasto tra tessuti di diversa densità. Nonostante l’elevata sensibilità, la RM non è solitamente utilizzata come tecnica di imaging di primo livello in quanto tecnica costosa e di non facile disponibilità per l’elevato numero di pazienti affetti da OA (Pradsgaard D, et al. J Rheumatol 2015).
L’ecografia articolare è stata meno studiata, tuttavia permette di ottenere immagini multiplanari ad alta risoluzione dei tessuti che la stanno rendendo una metodica di grande interesse sia per scopi di ricerca che nella pratica clinica quotidiana. I cambiamenti morfologici della superficie ossea, dei menischi e della cartilagine femorale possono essere rappresentati in modo affidabile e valutati in modo semi-quantitativo e/o come caratteristiche singole all’esame ecografico (Koski JM, et al. Scand J Rheumatol 2016; Kawaguchi K, et al. Arthritis Rheum 2012; Bruyn GA, et al. Ann Rheum Dis 2016). L’ecografia inoltre presenta il grande vantaggio di poter indentificare le lesioni infiammatorie. E’ una metodica economica, sicura, non comporta radiazioni ionizzanti e, nel complesso, non ci sono controindicazioni al suo utilizzo (Grassi W, et al. Semin Arthritis Rheum 1999; D Agostino MA, et al. Rheumatology (Oxford) 2015). Pertanto, le evidenze a sostegno della validità dell’ecografia articolare rispetto a modalità di imaging tradizionali sono in aumento(Koski JM, et al. Scand J Rheumatol 2016; Riecke BF, et al. Osteoarthritis Cartilage 2014; Naredo E, et al. Osteoarthritis Cartilage 2005). Tali evidenze supportano l’ipotesi di poter utilizzare l’ecografia come modalità di imaging di prima linea per la rilevazione dei cambiamenti morfologici in corso di OA. In questa rassegna descriviamo lo “stato dell’arte” dell’ecografia articolare nell’ambito della patologia artrosica.
I rilievi patologici documentabili con l’ecografia in corso di OA
SINOVITE
Benché l’OA sia ampiamente considerata come un disturbo degenerativo della cartilagine articolare, una quota di infiammazione sinoviale spesso presente. Una valutazione accurata, anche con metodiche strumentali, dell’infiammazione sinoviale è importante anche per poter inquadrarla correttamente e distinguere l’OA da un reumatismo infiammatorio cronico. Anche se la radiografia convenzionale può mostrare lesioni che influenzano il profilo osseo, individuare l’infiammazione sinoviale tramite una radiografia è difficile. Contrariamente, l’ecografia articolare e la RM sono state riconosciute come preziosi strumenti per valutare l’impegno infiammatorio dei tessuti sinoviale (Østergaard M, et al. Best Pract Res Clin Rheumatol 2008; Wakefield RJ, et al. Clin Exp Rheumatol 2003). L’Outcome Measures in Rheumatology (OMERACT) Working Group in ecografia, tra i segni di infiammazione dei tessuti molli ha definito “ipertrofia sinoviale” il tessuto intra-articolare anormale ipoecogeno (relativamente al grasso sottocutaneo) che non è spostabile e scarsamente comprimibile, e che può presentare un segnale Doppler (Wakefield RJ, et al. J Rheumatol 2005). Il segnale Doppler, in particolare il power Doppler (PD), può permettere di visualizzare il grado di infiammazione sinoviale valutando l’iperemia (Fig. 1b). Nell’artrite reumatoide ad esempio il segnale PD elevato è associato ad una sinovite “attiva”, che si caratterizza per la neoangiogenesi e per l’infiltrazione di cellule infiammatorie come i macrofagi e le cellule T-helper-17 (Gullick NJ, et al. PLoS One 2010). La presenza del segnale PD ecografico correla maggiormente con i rilievi istopatologici rispetto al quadro RM, ma le caratteristiche distinte di entrambe le modalità di valutazione imaging delle malattie croniche articolari sono important (Takase K, et al. Clin Exp Rheumatol 2012).
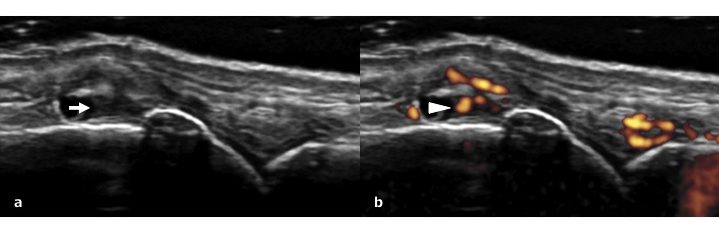
Figura 1: a) Ipertrofia sinoviale (freccia) a livello nell’articolazione metacarpofalangea. b) Segnale Power Doppler nel tessuto sinoviale (testa di freccia) indicativo di sinovite.
LIQUIDO SINOVIALE
Il gruppo di lavoro OMERACT ha definito il “liquido sinoviale” come materiale intra-articolare anecogeno o ipoecogeno (sempre relativamente al grasso sottocutaneo) che è spostabile e comprimibile, ma che non mostra un segnale Doppler (Wakefield RJ, et al. J Rheumatol 2005) (Fig. 2a). L’aspetto del liquido sinoviale come materiale intra-articolare anecogeno o ipoecogeno, con caratteristiche disomogenee, può dipendere dalla presenza nel contesto del liquido stesso di detriti intra-articolari o di materiale proteico o calcificato (Fig. 2b). La quantità intra-articolare di liquido sinoviale tende correla con l’attività infiammatoria nell’articolazione stessa. L’ecografia può anche essere usata molto efficacemente come guida per l’esecuzione di artrocentesi. L’aspirazione del liquido sinoviale è molto importante in alcuni casi per poter risolvere i le insidie diagnostico-differenziali.
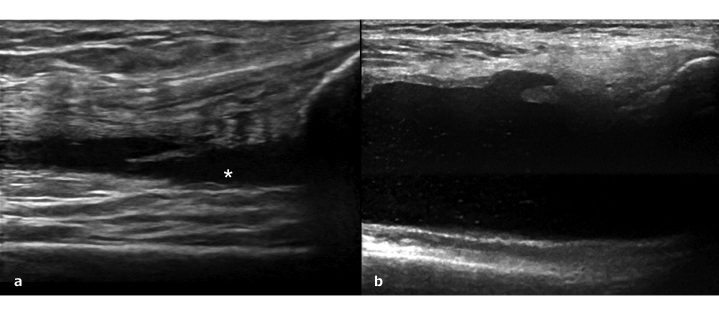
Figura 2: a) Liquido sinoviale identificabile come raccolta anecogena anormale (asterisco) all’interno dell’articolazione di ginocchio. b) Deposizioni calcifiche multiple osservabili nel liquido sinoviale del ginocchio di un paziente affetto da malattia da deposito di cristalli di pirofosfato di calcio.
CARTILAGINE
La valutazione ecografica della cartilagine ha alcuni limiti per quanto riguarda la finestra acustica (Mathiessen A, et al. Best Pract Res Clin Rheumatol 2016). Nell’articolazione di ginocchio, mentre una buona parte della cartilagine femorale è visibile, la maggior parte della superficie cartilaginea tibiale e rotulea non sono visibili. In questo contesto è molto importante anche la tecnica di esecuzione dell’esame ecografico, come mantenere l’angolo della sonda perpendicolare alle superficie oggetto di studio. La cartilagine ialina normale viene visualizzata ecograficamente come uno strato omogeneo anecogeno che riveste la corticale ossea, con un margine superficiale e profondo che appare sottile, tagliente, continuo e regolarmente iperecogeno (Fig. 3a). Per alterazioni patologiche della cartilagine si intendono delle immagini ecografiche che rilevino la perdita di nitidezza e/o irregolarità del margine superficiale/profondo, la perdita della normale struttura anecogena, nonché l’assottigliamento focale e asimmetrico fino alla completa perdita dello strato cartilagineo (Iagnocco A, et al. Clin Exp Rheumatol 2017) (Fig. 3b).
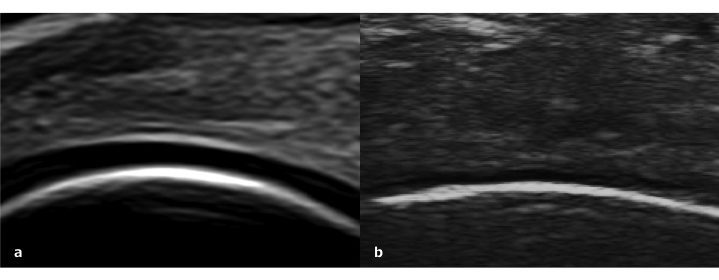
Figura 3: a)Cartilagine ialina normale visualizzata come uno strato omogeneamente anecogeno (Aplio i800 con sonda a 24 MHz “trasduttore ad altissima frequenza”, Canon Medical Systems). b)Cartilagine ialina danneggiata.
OSTEOFITI
Un osteofita è definito come un’aumentata prominenza ossea all’estremità del normale profilo osseo o ai margini dell’articolazione, visibile in due piani perpendicolari, con o senza ombra acustica (Iagnocco A, et al. Clin Exp Rheumatol 2017) (Fig. 4). Le dimensioni degli osteofiti sono correlate alla gravità del danno articolare e alla durata dell’OA. L’ecografia articolare si è dimostrata una tecnica sensibile per la rilevazione degli osteofiti, anche di minime dimensioni, comparata alla radiografia convenzionale (Iagnocco A, et al. Clin Exp Rheumatol 2017; Okano T, et al. Rheumatology (Oxford) 2016). In un lavoro del nostro gruppo di ricerca, l’ecografia ha permesso di rivelare la presenza di osteofiti a livello del condilo femorale mediale in una significativa percentuale di pazienti dove la radiografia era sostanzialmente nella norma (Okano T, et al. Rheumatology (Oxford) 2016). La multiplanarità dell’ecografia ha una maggiore sensibilità rispetto alla radiografia, essendo quest’ultima in grado di rilevare chiaramente solo gli osteofiti situati perpendicolarmente al fascio di raggi X. Di conseguenza l’ecografia acquisisce anche piccoli osteofiti nascosti in radiologia convenzionale.
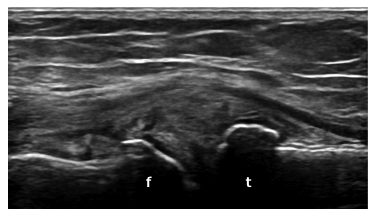
Figura 4: Osteofiti a livello del condilo femorale mediale (f) e della tibia (t) nell’articolazione del ginocchio.
EROSIONI
Un’erosione è definita come una discontinuità della superficie ossea intra-articolare visibile ecograficamente in due piani perpendicolari (Iagnocco A, et al. Clin Exp Rheumatol 2017) (Fig. 5). La presenza di una OA erosiva è tipica di determinati distretti, come la mano. In caso di OA erosiva, oltre al danno cartilagineo ed ai fenomeni osteoproduttivi, sono documentabili alterazioni del profilo osseo. L’OA erosiva oltre ad esibire le caratteristiche sopra menzionate, mostra anche segni flogistici (a volte chiamata “OA infiammatoria”), come l’ipertrofia sinoviale, la presenza di essudato intra-articolare ed eventualmente di segnale PD. Per l’OA erosiva delle mani è stato dimostrato che il PD (ma non l’ipertrofia sinoviale) è associato ad una progressione erosiva documentabile in radiografia convenzionale (Mancarella L, et al. Osteoarthritis Cartilage 2015).
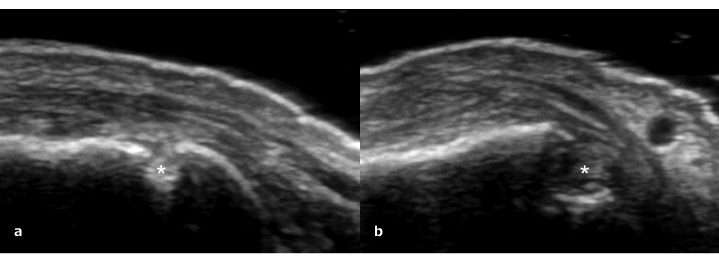
Figura 5: Erosione (asterisco) visibile come discontinuità della corticale ossea visibile su due piani perpendicolari, la scansione dorsale longitudinale (a) e la scansione dorsale trasversale (b).
Osteoartrosi del ginocchio
L’ECOGRAFIA NELL’OA DEL GINOCCHIO
Sebbene l’OA possa interessare molteplici articolazioni, l’OA del ginocchio sicuramente è la più comune e coinvolge molteplici strutture articolari, tra cui menischi, legamenti, osso subcondrale, capsula sinoviale ma anche la muscolatura periarticolare (Poole AR HSS J 2012). La prevalenza dell’OA di ginocchio nelle popolazioni anziane è in aumento ed impatta in maniera negativa sulla qualità di vita e sulla capacità lavorativa, determinando forti ripercussioni sui sistemi sanitari e nell’economia nel suo complesso (Cross M, et al. Ann Rheum Dis 2014; Wick MC, et al. Gerontology 2014).
La degenerazione della cartilagine articolare e meniscale, la formazione di osteofiti, l’erosione ossea, l’infiammazione sinoviale ed il versamento articolare sono i principali rilievi semeiologici dell’OA del ginocchio. L’ecografia ad alta risoluzione può essere utilizzata per valutare le strutture più superficiali del ginocchio, come il tessuto sinoviale, cartilagine, menischi, gli osteofiti, e la presenza di un eventuale versamento articolare.
LA SINOVITE IN CORSO DI OA DI GINOCCHIO
La proliferazione del tessuto sinoviale, responsabile dei rilievi flogistici, in caso di OA di ginocchio è solitamente di basso grado, e può essere visualizzata con o senza liquido sinoviale e/o segnale PD, anche se alcuni pazienti possono avere una sinovite di grado severo come quella dell’artrite reumatoide. Nei pazienti con artrite reumatoide, la persistenza di segnale PD può precedere l’insorgenza di un danno erosivo. Anche in corso di OA è stato dimostrato che la sinovite, documentabile come la presenza di versamento intra-articolare rilevabile all’ecografia, sia un fattore predittivo della necessità di una successiva artroplastica totale di ginocchio (Conaghan PG, et al. Ann Rheum Dis 2010). Pertanto, la sinovite del ginocchio rilevata all’ecografia può essere un bersaglio di trattamento, e l’ecografia può essere considerata una misura di outcome per gli studi che intendono misurare la flogosi in corso di OA.
LA CARTILAGINE IN CORSO DI OA DI GINOCCHIO
Misurare lo “stato di salute” della cartilagine e identificarne precocemente i cambiamenti è molto importante per valutare l’efficacia di possibili trattamenti per ridurre la progressione dell’OA di ginocchio (Eckstein F, et al. Osteoarthritis Cartilage 2006). Sebbene l’esame ecografico della cartilagine di ginocchio possa essere limitato a causa della profondità e della mancanza di una visualizzazione adeguata, alcune scansioni permettono di ottenere informazioni importanti. Ecograficamente, la cartilagine ialina normale viene visualizzata come uno strato ipoecogeno, tipicamente di 1.5-2 mm di spessore (Aisen AM, et al. Radiology 1984). Lo spessore della cartilagine è una misura importante per rilevare l’insorgenza ed eventualmente la progressione dell’OA dal momento che questa patologia si caratterizza, almeno nelle fasi inziale, per una riduzione dello spessore cartilagineo. I pazienti con OA di ginocchio hanno una riduzione dello spessore della cartilagine tibiofemorale rispetto ai controlli sani (Buck RJ, et al. Osteoarthritis Cartilage 2010; Cicuttini FM, et al. Ann Rheum Dis 2001). È stato suggerito che misurare la cartilagine al centro del condilo femorale mediale possa rappresentare un utile parametro per valutare i cambiamenti morfologici precoci nell’OA di ginocchi (Frobell RB, et al. Osteoarthritis Cartilage 2009). Pertanto, strumenti accurati ed efficaci per misurare lo spessore della cartilagine femorale mediale potrebbero essere clinicamente molto utili per monitorare la malattia. L’ecografia aggiunge ai vantaggi sopra elencati il fatto di essere economica e più disponibile maggiormente sofisticate come la RM (Ostergaard M, et al. Acta Radiol 1995). Il nostro gruppo ha dimostrato che il danno alla cartilagine femorale mediale è fortemente correlato al restringimento radiografico dell’articolazione tibiofemorale mediale, e che l’ecografia è una tecnica di imaging sensibile per rilevare i danni alla cartilagine anche nelle prime fasi radiografiche dell’OA di ginocchio (Okano T, et al. Rheumatology (Oxford) 2016). In un confronto tra ecografia ed RM per la misurazione dello spessore della cartilagine nel condilo femorale mediale, Randy e colleghi hanno documentato che le misurazioni ecografiche trasversali e longitudinali erano correlate positivamente ed in maniera significativa con le misurazioni RM e, di conseguenza, ciò certifica come l’ecografia possa essere utilizzata in maniera affidabile per valutare lo spessore della cartilagine nelle regioni femorali mediali (Schmitz RJ, et al. Knee 2017)
I MENISCHI IN CORSO DI OA DI GINOCCHIO
Il menisco mediale e laterale sono visualizzati ecograficamente come strutture triangolari iperecogene situate tra femore e tibia (Fig. 6a). Le porzioni periferiche dei menischi possono essere visualizzate chiaramente, al contrario le porzioni più interne sono scarsamente identificabili. Complessivamente, la visualizzazione del menisco laterale tende ad essere più limitata. La sensibilità e la specificità dell’esame ecografico per la diagnosi di una lesione meniscale sono rispettivamente dell’88% e dell’85% (Akatsu Y, et al. J Bone Joint Surg Am 2015). Altri studi descrivono come l’ecografia possa essere utilizzata per identificare le lesioni meniscali mediali e laterali con un’accuratezza paragonabile a quella della RM (Mureşan S, et al. J Sports Med Phys Fitness 2017). Come già accennato, è spesso difficile differenziare la degenerazione meniscale interna con l’ecografia, per cui il ricorso alla RM è giustificato dal punto di vista diagnostico. L’ecografia è molto utile nella diagnosi strumentale dell’estrusione meniscale mediale (Fig. 6b), lesione artrosica tipica, correlata alla sintomatologia dolorosa e alla riduzione della rima articolare mediale documentabile in radiologia convenzionale (Naredo E, et al. Osteoarthritis Cartilage 2005). Inoltre, l’esame ecografico dinamico dei menischi in posizione unipodale prima e dopo aver camminato per 50 m potrebbe essere un metodo riproducibile per la diagnosticare sublussazioni meniscali (Acebes C, et al. Rheumatology (Oxford) 2013).
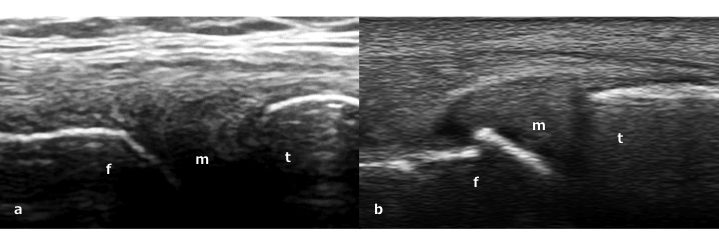
Figura. 6 a) Posizione normale del menisco mediale. b) Estrusione meniscale mediale con piccolo osteofita a livello femorale in un paziente artrosico. f: condilo femorale mediale, t: t: tibia prossimale, m: menisco mediale.
GLI OSTEOFITI IN CORSO DI OA DI GINOCCHIO
Le strutture ossee del ginocchio sono utilizzate principalmente come punti di repere per l’esame ecografico dei tessuti molli sovrastanti. L’ecografia ha tuttavia una sua utilità anche nel fornire informazioni delle alterazioni patologiche che avvengono sulla superficie dell’osso. Un esempio tipico sono gli osteofiti dell’articolazione femorotibiale del ginocchio artrosico (Abraham AM, et al. BMC Musculoskelet Disord 2011). Koski e colleghi hanno dimostrato che una valutazione ecografica semi-quantitativa è più sensibile della radiografia nell’identificazione di osteofiti nel compartimento mediale del ginocchio (Koski JM, et al. Scand J Rheumatol 2016). Anche un nostro lavoro ha dimostrato le correlazioni significative tra i gradi radiografici e quelli ecografici degli osteofiti femorali, sia per l’aspetto articolare mediale e laterale. L’ecografia inoltre è in grado di documentare la presenza di piccoli e precoci osteofiti, non altrimenti rilevabili con la radiologia convenzionale (Okano T, et al. Rheumatology (Oxford) 2016).
LA CISTI DI BAKER
La cisti di Baker è la presenza di tumefazione nella regione posteriore del ginocchio, a livello del cavo popliteo, in continuità con l’articolazione, che causa rigidità e dolore (Fig. 7). La cisti di Baker è considerata uno dei segni infiammatori dell’OA di ginocchio. L’esame ecografico del cavo popliteo può rilevare la presenza di una cisti di Baker più frequentemente dell’esame clinico anche in pazienti senza sintomi clinici a tale livello (Akgul O, et al. Int J Rheum Dis 2014). Uno studio prospettico di coorte ha mostrato una progressione radiologica accelerata, valutata in due anni di follow-up, in pazienti affetti da OA di ginocchio con cisti di Baker ecografica al basale (Bevers K, et al. Rheumatology (Oxford) 2015). Vi sono evidenze che l’aspirazione della cisti con infiltrazione ecoguidata di corticosteroidi produca un miglioramento clinico, una riduzione volumetrica della cisti stessa ed anche delle sue dimensioni di parete (Köroğlu M, et al. Eur J Radiol 2012; Acebes JC, et al. J Clin Ultrasound 2006). Pertanto lo studio ecografico del cavo popliteo dovrebbe essere attuto in ogni ginocchio artrosico per individuare una cisti di Baker e per poterla trattare.
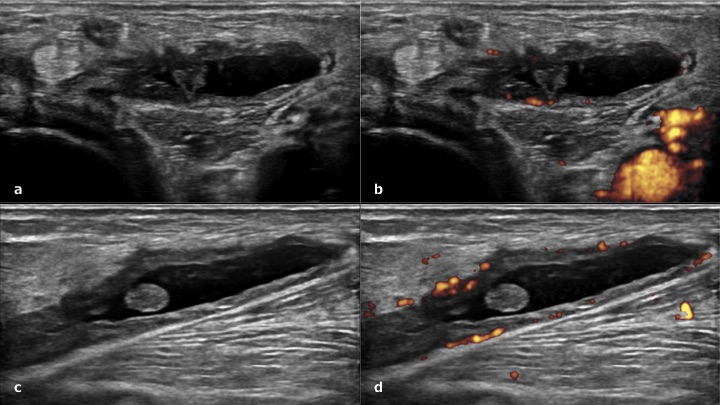
Figura. 7 Cisti di Baker nella regione posteriore di ginocchio. a-b) scansione trasversale e c-d) scansione longitudinale.
DIAGNOSI DIFFERENZIALE NELL’OA DI GINOCCHIO
Diverse condizioni devono essere identificate e differenziate dall’OA di ginocchio, in particolare le artropatie da cristalli quali la malattia di deposizione del pirofosfato di calcio (CPPD) e la gotta. In entrambe le malattie l’ecografia può rilevare segni altamente specifici a livello della cartilagine articolare.
Nel ginocchio dei pazienti con gotta, i cristalli di urato monosodico possono apparire come una linea iperecogena sulla superficie della cartilagine ialina, definito come segno del “doppio contorno” (Thiele RG, et al. Rheumatology (Oxford) 2007) (Fig. 8). La presenza di un segno del doppio contorno è suggestivo di gotta con una sensibilità dell’83% ed una specificità del 76% (Ogdie A, et al. Ann Rheum Dis 2015).Il segno del doppio contorno, identificato correttamente con il fascio ultrasonoro perpendicolare alla cartilagine stessa, si differenzia dalla normale interfaccia cartilaginea presentandosi come una deposizione continua ed iperecoica. Il segno del doppio contorno deve essere differenziato dai depositi tipici della CPPD, che appaiono come focolai calcifici iperecogeni presenti all’interno della cartilagine ialina (Thiele RG, et al. Rheumatology (Oxford) 2007; Filippucci E, et al. Osteoarthritis Cartilage 2009). La CPPD è caratterizzata dalla deposizione intra-articolare e/o peri-articolare di cristalli di pirofosfato di calcio (McCarty DJ, Br J Rheumatol 1993). Depositi di cristalli di pirofosfato di calcio, oltre che nel contesto della cartilagine ialina (Fig. 9a), si trovano molto frequentemente nelle fibrocartilagini meniscali (Louthrenoo W, et al. J Med Assoc Thai 1999). L’ecografia è molto utile anche nell’individuazione dei cristalli di pirofosfato di calcio ed ha un ruolo nella diagnosi di CPPD. Gutierrez e colleghi hanno dimostrato che l’ecografia sembrerebbe essere più utile della radiologia convenzionale nel diagnosticare questa condizione, dal momento che immagini suggestive della presenza di una CPPD a livello della cartilagine ialina sono documentabili nel 59.5% dei pazienti versus il 45.9% della radiografia (p<0.001). L’ecografia è dunque una metodica accurata e affidabile per la diagnosi delle calcificazioni della cartilagine articolare in corso di CPPD (Gutierrez M, et al. Arthritis Care Res Hoboken 2014). Come già accennato, la CPPD può coinvolgere anche i menischi (Fig. 9b), ed a questo livello i depositi appaiono come aree iperecogene interne al menisco stesso (Frediani B, et al. Ann Rheum Dis 2005). Anche a livello meniscale l’ecografia è una metodica più sensibile della radiologia convenzionale (90.5% versus 83.7%) (p=0,011) (Gutierrez M, et al. Arthritis Care Res Hoboken 2014) (Fig. 9c).
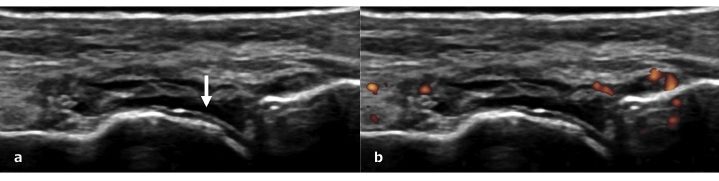
Figura. 8 a) Segno del “doppio contorno” (freccia) sulla testa metatarsale del paziente con gotta. B) Sinovite con infiammazione a basso grado.
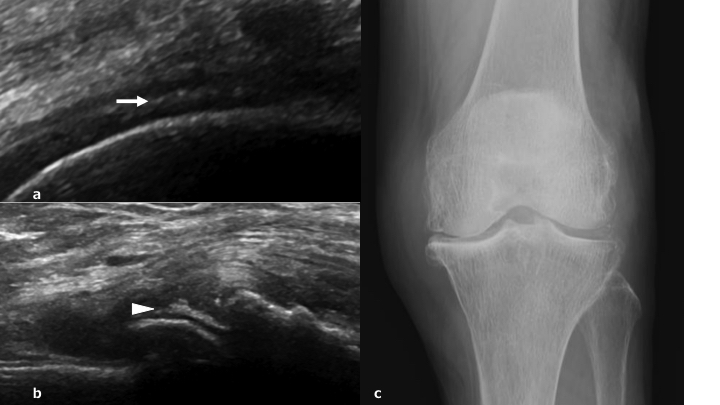
Figura. 9 a) Calcificazione nel menisco mediale in paziente con malattia da deposito di cristalli di pirofosfato di calcio (freccia). b) Calcificazione della cartilagine ialina femorale (testa di freccia). c) Radiografia convenzionale.
Osteoartrosi della mano
L’ECOGRAFIA NELL’OA DELLA MANO
L’OA della mano è una malattia ad elevata prevalenza nella popolazione generale, determinante dolore e disabilità (Slatkowsky-Christensen B, et al. Arthritis Rheum 2007). Haugen e collaboratori hanno descritto una prevalenza di OA della mano nel 44% delle donne e nel 38% degli uomini al di sopra dei 40 anni (Haugen IK, et al. Ann Rheum Dis 2011). Tuttavia, la prevalenza dell’OA della mano utilizzando come metodica diagnostica la radiologia convenzionale non è nota a causa della notevole variabilità tra gli studi, che può essere dovuta a differenze tra le popolazioni studiate (ad esempio, background genetico o esposizioni ambientali) ed alla definizione stessa di malattia (Mathiessen A, et al. Ann Rheum Dis 2016). L’OA della mano frequentemente colpisce la prima articolazione carpometacarpale (detta anche artrosi della base del pollice o rizoartrosi) e dalla II alla V interfalangea distale, ma si può trovare anche a livello delle articolazioni interfalangee prossimali e più raramente a carico delle articolazioni metacarpofalangee. L’ecografia ad alta risoluzione può essere utilizzata per valutare le strutture superficiali delle articolazioni delle dita, il tessuto sinoviale, la cartilagine articolare e gli osteofiti.
LA CARTILAGINE IN CORSO DI OA DELLA MANO
La valutazione ecografica della cartilagine nelle articolazioni delle dita viene effettuata ai massimi gradi di flessione dell’articolazione oggetto di studio (Fig. 3a). Il gruppo di lavoro OMERACT ha proposto un sistema di punteggio semiquantitativo per interpretare le anomalie della cartilagine della mano artrosica (Hammer HB, et al. Ann Rheum Dis 2016). Questa scala a quattro punti definisce: 0 = cartilagine normale (struttura anecogena, normali margini della cartilagine); 1 = perdita della struttura anecogena e/o assottigliamento focale dello strato cartilagineo o irregolarità e/o perdita di nitidezza di almeno un margine cartilagineo; 2 = perdita della struttura anecogena e/o assottigliamento focale dello strato cartilagineo e irregolarità e/o perdita di nitidezza di almeno un margine cartilagineo; 3 = assenza focale o perdita completa dello strato cartilagineo. Le sonde ecografica ad alta frequenza possono visualizzare chiaramente in dettaglio anche minime alterazioni cartilaginee (ad es. 0.1 mm). Questa possibilità di identificare con tecniche ad alta risoluzione minimi dettagli della cartilagine potrà essere utile anche per studiare farmaci “disease modifying” per l’OA.
GLI OSTEOFITI IN CORSO DI OA DELLA MANO
Gli osteofiti sono lesioni tipiche anche per l’OA della mano, ed è stato dimostrato che la loro presenza si accompagna alla sintomatologia dolorose (Kortekaas MC, et al. Ann Rheum Dis 2011). L’ecografia è più sensibile dell’esame clinico e della radiografia nella rilevazione degli osteofiti nelle articolazioni della mano (Keen HI, et al. Ann Rheum Dis 2008) (Fig. 10a). Mathiessen e colleghi hanno descritto un buon accordo tra la diagnosi ecografica e la diagnosi RM degli osteofiti. Anche in questo distretto un grosso vantaggio dell’ecografia è rappresentato dalla possibilità di uno studio multiplanare, permettendo l’identificazione anche di piccoli osteofiti nascosti (Mathiessen A, et al. Ann Rheum Dis 2013).
LA SINOVITE IN CORSO DI OA DELLA MANO
L’ecografia articolare è uno strumento utile anche per individuare la sinovite in corso di OA della mano. Contrariamente a quanto si possa credere, la sinovite ha una prevalenza molto elevata nelle articolazioni dolorose della mano artrosica. Nell’ambito delle malattie infiammatorie croniche come l’artrite reumatoide, la sinovite prolungata genera un danno articolare erosivo. Anche per la patologia artrosica, la sinovite ecografica documentabile in scala di grigi (Fig. 10a) ed il segnale PD (Fig. 10b) sono associati in modo significativo alla progressione radiografica dopo 5 anni (Mathiessen A, et al. Ann Rheum Dis 2016). L’ecografia può documentare anche la presenza dell’efficacia di un trattamento. Klauser e colleghi hanno documentato che effettuando infiltrazioni intra-articolari di acido ialuronico in pazienti con OA della mano si può riscontrare una riduzione dello spessore della membrana sinoviale e del segnale PD (Klauser AS, et al. Eur J Radiol 2012).
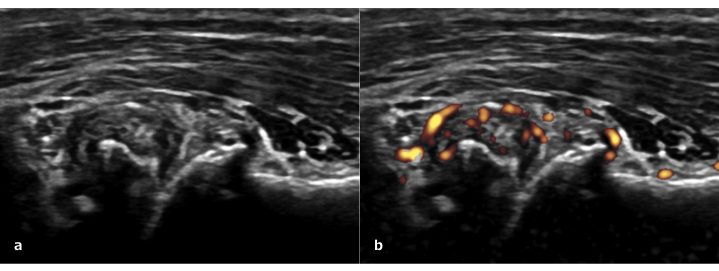
Figura. 10 a) Proliferazione osteofitaria e segni di ipertrofia sinoviale nella prima articolazione carpometacarpale (rizoartrosi). b) Segnale Power Doppler nel tessuto sinoviale ipertrofico.
DIAGNOSI DIFFERENZIALE NELL’OA DELLA MANO
L’artrite psoriasica è una patologia infiammatoria che si sviluppa nel 5-40% dei pazienti con psoriasi (Weger W, Br J Pharmacol 2010). Una delle caratteristiche dell’artrite psoriasica è la presenza di fenomeni osteoproduttivi nelle articolazioni e nelle entesi infiammate. L’artrite psoriasica colpisce frequentemente le articolazioni interfalangee distali e, in questa sede, i processi flogistici articolari dell’artrite psoriasica possono essere confusi con quelli artrosici. Studi in tomografia computerizzata quantitativa periferica ad alta risoluzione hanno dimostrato che le caratteristiche dei fenomeni osteoproduttivi sono diverse in queste due malattie (Finzel S, et al. Arthritis Rheumatol 2014). Se complessivamente il numero e le dimensioni degli osteofiti in corso di OA e della periosteite in corso di artrite psoriasica possano essere molto simili, tuttavia, la localizzazione delle lesioni all’interno delle singole articolazioni è sostanzialmente diversa nelle due condizioni. Gli osteofiti osservati nell’OA della mano sono quasi perpendicolare allo spazio articolare (Fig. 11a), al contrario, i fenomeni osteoproduttivi tipici dell’artrite psoriasica sono solitamente visibili come alterazioni parallele alla fibra del tendine estensore delle dita, alla capsula o al legamento, in quanto espressione di entesite (Fig. 11b).
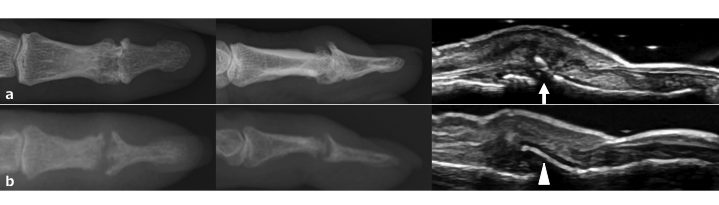
Figura. 11 a) Osteofita osservabile nell’OA della mano, lesione quasi perpendicolare allo spazio articolare (freccia). b) I fenomeni osteoproduttivi (periosteite) nei pazienti con artrite psoriasica sono di solito paralleli alla fibre del tendine, alle capsule o ai legamenti (testa di freccia).
Terapia locoregionale ecoguidata in corso di OA
Le iniezioni intra-articolari di corticosteroidi o la viscosupplementazione sono tuttora ampiamente utilizzate nell’ambito della patologia artrosica, soprattutto le terapie conservative di prima linea (riposo, ghiaccio e farmaci antinfiammatori) non sono in grado di fornire un adeguato sollievo dai sintomi.
Le iniezioni intra-articolari di corticosteroidi forniscono benefici a breve termine ed efficacia clinica per il dolore cronico al ginocchio (Zhang W, et al. Osteoarthritis Cartilage 2010).
Nel corso degli ultimi anni diverse formulazioni iniettabili di acido ialuronico sono disponibili ed hanno ottenuto un certo grado di accettazione come strategia di trattamento efficace per l’OA di ginocchio.
Tradizionalmente, le terapie infiltrative intra-articolari sono state effettuate utilizzando punti di repere anatomici per poter effettuare un corretto posizionamento dell’ago. Tuttavia, nonostante la correttezza dei reperi anatomici, una significativa proporzione di infiltrazioni eseguite alla cieca finiscono fuori bersaglio. Ciò è dovuto, in gran parte, al fatto che l’operatore con tecnica “free hand” non è in grado di visualizzare direttamente l’area di interesse e le variazioni anatomiche sono comuni. L’errato posizionamento dell’ago è stato attribuito (almeno in parte) a esiti clinici variabili (McGarry JG, et al. Knee Surg Sports Traumatol Arthrosc 2011). Un’infiltrazione eseguita non correttamente può avere diversi effetti collaterali, tra i quali il dolore post-iniezione, l’emartrosi, la sepsi articolare, atrofia della cartilagine articolare, nonché effetti sistemici (ad esempio, ritenzione idrica o esacerbazione dell’ipertensione o diabete mellito) (Bellamy N, et al. Cochrane Database Syst Rev 2006). Pertanto, poter identificare correttamente il percorso ed il corretto posizionamento dell’ago è importate per una buona riuscita del trattamento infiltrativo.
Fluoroscopia, tomografia computerizzata e RM possono essere utilizzate per migliorare la precisione dei trattamenti infilitrativi intra-articolari. Tuttavia, l’ecografia è molto più pratica rispetto alle metodiche sopra elencate perché è rapida, sicura, poco costosa, non emette radiazioni ionizzanti, e può essere effettuata in ambiente ambulatoriale (Iagnocco A, et al. Rheumatology (Oxford) 2010). L’ecografia consente di identificare le strutture vascolari e nervose e documentano il movimento dell’ago in tempo reale (Epis O, et al. Clin Exp Rheumatol 2008). David e colleghi hanno dimostrato che la guida ecografica porta ad una migliore accuratezza rispetto alla guida anatomica (95.8% versus 77.8%, p<0.001) nelle infiltrazioni a livello del ginocchio, e che la maggiore accuratezza del trattamento effettuato con la guida ecografica determina migliori risultati clinici (Berkoff DJ, et al. Clin Interv Aging 2012). La precisione del trattamento infiltrativo è ancor più importante nelle piccole articolazioni (Fig 12).
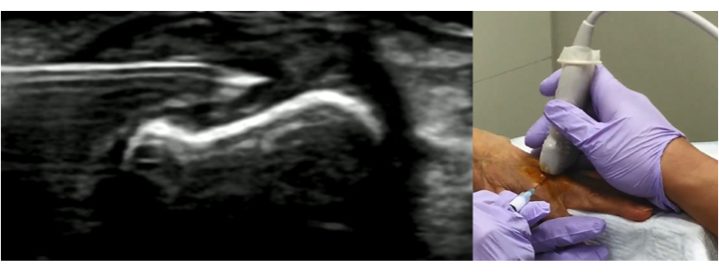
Figura. 12 Infiltrazione ecoguidata in un’articolazione metacarpofalangea.
Conclusioni
L’imaging è il pilastro della gestione dei pazienti OA nella pratica clinica quotidiana, e la radiografia convenzionale rimane il gold standard. Tuttavia, rispetto alla radiografia, l’ecografia può identificare più precocemente le alterazioni morfologiche cartilaginee e gli osteofiti anche di piccole dimensioni. L’ecografia fornisce ulteriori informazioni diagnostiche pertinenti sulle alterazioni patologiche dei tessuti molli (ad es. sinovite, lesioni meniscali e cisti di Baker), non rilevabili con la radiografia convenzionale. Di conseguenza, l’uso dell’ecografia come tecnica di imaging complementare alla radiografia (soprattutto se la RM non è giustificata) potrebbe consentire una diagnosi più accurata ed economica dell’OA di ginocchio.
Rispetto alla RM, l’ecografia consente un esame dinamico e l’ecografista può osservare i tessuti visualizzati durante il movimento attivo e passivo. Paragonata alla RM, il principale limite dell’ecografia è rappresentato dall’impossibilità di studiare l’osso subcondrale. L’ecografista deve saper riconoscere i vantaggi e gli svantaggi di ogni tecnica di imaging ed adeguare l’esame adatto alla problematica clinica del singolo paziente.
Punti chiave
- Se da un lato radiologia convenzionale e la risonanza magnetica rimangono le tecniche di imaging di riferimento, nel corso degli ultimi anni l’ecografia ha assunto un ruolo sempre più importante nell’ambito della patologia artrosica. I vantaggi generali dell’ecografia sono principalmente rappresentati dalla pronta disponibilità, dal basso costo, dall’assenza di radiazioni ionizzanti, e dalla ripetibilità della metodica.
- In corso di osteoartrosi i vantaggi dell’ecografia sono rappresentati dalla possibilità di visualizzare precocemente alterazioni molto iniziali della patologia sia a livello cartilagineo, sia a carico dei tessuti molli (tessuto sinoviale, mensichi, capsula articolare), sia a livello del profilo osseo (osteofiti, erosioni).
- I principali svantaggi sono lo studio di zone scarsamente accessibili con gli ultrasuoni, come la porzione laterale del ginocchio, o non completamente accessibili, come l’osso subcondrale.
Bibliografia
- Dawson J, Linsell L, Zondervan K, Rose P, Randall T, Carr A, Fitzpatrick R (2004) Epidemiology of hip and knee pain and its impact on overall health status in older adults. Rheumatology (Oxford) 43:497-504.
- Roemer FW, Eckstein F, Hayashi D, Guermazi A (2014) The role of imaging in osteoarthritis. Best Pract Res Clin Rheumatol 28:31-60.
- Kellgren JH, Lawrence JS (1957) Radiological assessment of osteo-arthrosis. Ann Rheum Dis 16:494-502.
- Reichmann WM, Maillefert JF, Hunter DJ, Katz JN, Conaghan PG, Losina E (2011) Responsiveness to change and reliability of measurement of radiographic joint space width in osteoarthritis of the knee: a systematic review. Osteoarthritis Cartilage 19:550-556.
- Wang Y, Wluka AE, Jones G, Ding C, Cicuttini FM (2012) Use magnetic resonance imaging to assess articular cartilage. Ther Adv Musculoskelet Dis 4:77-97.
- Guermazi A, Hayashi D, Eckstein F, Hunter DJ, Duryea J, Roemer FW (2013) Imaging of osteoarthritis. Rheum Dis Clin North Am 39:67-105.
- Altman RD, Gold GE (2007) Atlas of individual radiographic features in osteoarthritis, revised. Osteoarthritis Cartilage 15 Suppl A:A1-56.
- Amin S, LaValley MP, Guermazi A, Grigoryan M, Hunter DJ, Clancy M, Niu J, Gale DR, Felson DT (2005) The relationship between cartilage loss on magnetic resonance imaging and radiographic progression in men and women with knee osteoarthritis. Arthritis Rheum 52:3152-3159.
- Hunter DJ, Zhang YQ, Tu X, Lavalley M, Niu JB, Amin S, Guermazi A, Genant H, Gale D, Felson DT (2006) Change in joint space width: hyaline articular cartilage loss or alteration in meniscus? Arthritis Rheum 54:2488-2495.
- Stammberger T, Eckstein F, Englmeier KH, Reiser M (1999) Determination of 3D cartilage thickness data from MR imaging: computational method and reproducibility in the living. Magn Reson Med 41:529-536.
- Pradsgaard D, Fiirgaard B, Spannow AH, Heuck C, Herlin T (2015) Cartilage thickness of the knee joint in juvenile idiopathic arthritis: comparative assessment by ultrasonography and magnetic resonance imaging. J Rheumatol 42:534-540.
- Koski JM, Kamel A, Waris P, et al. (2016) Atlas-based knee osteophyte assessment with ultrasonography and radiography: relationship to arthroscopic degeneration of articular cartilage. Scand J Rheumatol 45:158-164.
- Kawaguchi K, Enokida M, Otsuki R, Teshima R (2012) Ultrasonographic evaluation of medial radial displacement of the medial meniscus in knee osteoarthritis. Arthritis Rheum 64:173-180.
- Bruyn GA, Naredo E, Damjanov N, et al. (2016) An OMERACT reliability exercise of inflammatory and structural abnormalities in patients with knee osteoarthritis using ultrasound assessment. Ann Rheum Dis 75:842-846.
- Grassi W, Lamanna G, Farina A, Cervini C (1999) Sonographic imaging of normal and osteoarthritic cartilage. Semin Arthritis Rheum 28:398-403.
- D’Agostino MA, Iagnocco A, Aegerter P, et al. (2015) Does subclinical inflammation contribute to impairment of function of knee joints in aged individuals? High prevalence of ultrasound inflammatory findings. Rheumatology (Oxford) 54:1622-1629.
- Riecke BF, Christensen R, Torp-Pedersen S, Boesen M, Gudbergsen H, Bliddal H (2014) An ultrasound score for knee osteoarthritis: a cross-sectional validation study. Osteoarthritis Cartilage 22:1675-1691.
- Naredo E, Cabero F, Palop MJ, Collado P, Cruz A, Crespo M (2005) Ultrasonographic findings in knee osteoarthritis: a comparative study with clinical and radiographic assessment. Osteoarthritis Cartilage 13:568-574.
- Østergaard M, Pedersen SJ, Døhn UM (2008) Imaging in rheumatoid arthritis–status and recent advances for magnetic resonance imaging, ultrasonography, computed tomography and conventional radiography. Best Pract Res Clin Rheumatol 22:1019-1044.
- Wakefield RJ, Kong KO, Conaghan PG, Brown AK, O’Connor PJ, Emery P (2003) The role of ultrasonography and magnetic resonance imaging in early rheumatoid arthritis. Clin Exp Rheumatol 21:S42-49.
- Wakefield RJ, Balint PV, Szkudlarek M, et al. (2005) Musculoskeletal ultrasound including definitions for ultrasonographic pathology. J Rheumatol 32:2485-2487.
- Gullick NJ, Evans HG, Church LD, Jayaraj DM, Filer A, Kirkham BW, Taams LS (2010) Linking power Doppler ultrasound to the presence of th17 cells in the rheumatoid arthritis joint. PLoS One 5:
- Takase K, Ohno S, Takeno M, et al. (2012) Simultaneous evaluation of long-lasting knee synovitis in patients undergoing arthroplasty by power Doppler ultrasonography and contrast-enhanced MRI in comparison with histopathology. Clin Exp Rheumatol 30:85-92.
- Mathiessen A, Cimmino MA, Hammer HB, Haugen IK, Iagnocco A, Conaghan PG (2016) Imaging of osteoarthritis (OA): What is new? Best Pract Res Clin Rheumatol 30:653-669.
- Iagnocco A, Naredo E (2017) Ultrasound of the osteoarthritic joint. Clin Exp Rheumatol 35:527-534.
- Okano T, Filippucci E, Di Carlo M, Draghessi A, Carotti M, Salaffi F, Wright G, Grassi W (2016) Ultrasonographic evaluation of joint damage in knee osteoarthritis: feature-specific comparisons with conventional radiography. Rheumatology (Oxford) 55:2040-2049.
- Mancarella L, Addimanda O, Pelotti P, Pignotti E, Pulsatelli L, Meliconi R (2015) Ultrasound detected inflammation is associated with the development of new bone erosions in hand osteoarthritis: a longitudinal study over 3.9 years. Osteoarthritis Cartilage 23:1925-1932.
- Poole AR (2012) Osteoarthritis as a whole joint disease. HSS J 8:4-6.
- Cross M, Smith E, Hoy D, et al. (2014) The global burden of hip and knee osteoarthritis: estimates from the global burden of disease 2010 study. Ann Rheum Dis 73:1323-1330.
- Wick MC, Kastlunger M, Weiss RJ (2014) Clinical imaging assessments of knee osteoarthritis in the elderly: a mini-review. Gerontology 60:386-394
- Conaghan PG, D’Agostino MA, Le Bars M, et al. (2010) Clinical and ultrasonographic predictors of joint replacement for knee osteoarthritis: results from a large, 3-year, prospective EULAR study. Ann Rheum Dis 69:644-647.
- Eckstein F, Cicuttini F, Raynauld JP, Waterton JC, Peterfy C (2006) Magnetic resonance imaging (MRI) of articular cartilage in knee osteoarthritis (OA): morphological assessment. Osteoarthritis Cartilage 14 Suppl A:A46-75.
- Aisen AM, McCune WJ, MacGuire A, Carson PL, Silver TM, Jafri SZ, Martel W (1984) Sonographic evaluation of the cartilage of the knee. Radiology 153:781-784.
- Buck RJ, Wyman BT, Le Graverand MP, Hudelmaier M, Wirth W, Eckstein F, investigators A (2010) Osteoarthritis may not be a one-way-road of cartilage loss–comparison of spatial patterns of cartilage change between osteoarthritic and healthy knees. Osteoarthritis Cartilage 18:329-335.
- Cicuttini FM, Wluka AE, Stuckey SL (2001) Tibial and femoral cartilage changes in knee osteoarthritis. Ann Rheum Dis 60:977-980.
- Frobell RB, Le Graverand MP, Buck R, Roos EM, Roos HP, Tamez-Pena J, Totterman S, Lohmander LS (2009) The acutely ACL injured knee assessed by MRI: changes in joint fluid, bone marrow lesions, and cartilage during the first year. Osteoarthritis Cartilage 17:161-167.
- Ostergaard M, Court-Payen M, Gideon P, Wieslander S, Cortsen M, Lorenzen I, Henriksen O (1995) Ultrasonography in arthritis of the knee. A comparison with MR imaging. Acta Radiol 36:19-26.
- Schmitz RJ, Wang HM, Polprasert DR, Kraft RA, Pietrosimone BG (2017) Evaluation of knee cartilage thickness: A comparison between ultrasound and magnetic resonance imaging methods. Knee 24:217-223.
- Akatsu Y, Yamaguchi S, Mukoyama S, et al. (2015) Accuracy of high-resolution ultrasound in the detection of meniscal tears and determination of the visible area of menisci. J Bone Joint Surg Am 97:799-806.
- Mureşan S, Mureşan M, Voidăzan S, Neagoe R (2017) The accuracy of musculoskeletal ultrasound examination for the exploration of meniscus injuries in athletes. J Sports Med Phys Fitness 57:589-594.
- Acebes C, Romero FI, Contreras MA, Mahillo I, Herrero-Beaumont G (2013) Dynamic ultrasound assessment of medial meniscal subluxation in knee osteoarthritis. Rheumatology (Oxford) 52:1443-1447.
- Abraham AM, Goff I, Pearce MS, Francis RM, Birrell F (2011) Reliability and validity of ultrasound imaging of features of knee osteoarthritis in the community. BMC Musculoskelet Disord 12:70.
- Akgul O, Guldeste Z, Ozgocmen S (2014) The reliability of the clinical examination for detecting Baker’s cyst in asymptomatic fossa. Int J Rheum Dis 17:204-209.
- Bevers K, Vriezekolk JE, Bijlsma JW, van den Ende CH, den Broeder AA (2015) Ultrasonographic predictors for clinical and radiological progression in knee osteoarthritis after 2 years of follow-up. Rheumatology (Oxford) 54:2000-2003.
- Köroğlu M, Callıoğlu M, Eriş HN, et al. (2012) Ultrasound guided percutaneous treatment and follow-up of Baker’s cyst in knee osteoarthritis. Eur J Radiol 81:3466-3471.
- Acebes JC, Sánchez-Pernaute O, Díaz-Oca A, Herrero-Beaumont G (2006) Ultrasonographic assessment of Baker’s cysts after intra-articular corticosteroid injection in knee osteoarthritis. J Clin Ultrasound 34:113-117.
- Thiele RG, Schlesinger N (2007) Diagnosis of gout by ultrasound. Rheumatology (Oxford) 46:1116-1121.
- Ogdie A, Taylor WJ, Weatherall M, Fransen J, Jansen TL, Neogi T, Schumacher HR, Dalbeth N (2015) Imaging modalities for the classification of gout: systematic literature review and meta-analysis. Ann Rheum Dis 74:1868-1874.
- Filippucci E, Riveros MG, Georgescu D, Salaffi F, Grassi W (2009) Hyaline cartilage involvement in patients with gout and calcium pyrophosphate deposition disease. An ultrasound study. Osteoarthritis Cartilage 17:178-181.
- McCarty DJ (1993) Calcium pyrophosphate dihydrate crystal deposition disease. Br J Rheumatol 32:177-179.
- Louthrenoo W, Sukitawut W (1999) Calcium pyrophosphate dihydrate crystal deposition: a clinical and laboratory analysis of 91 Thai patients. J Med Assoc Thai 82:569-576.
- Gutierrez M, Di Geso L, Salaffi F, Carotti M, Girolimetti R, De Angelis R, Filippucci E, Grassi W (2014) Ultrasound detection of cartilage calcification at knee level in calcium pyrophosphate deposition disease. Arthritis Care Res (Hoboken) 66:69-73.
- Frediani B, Filippou G, Falsetti P, Lorenzini S, Baldi F, Acciai C, Siagkri C, Marotto D, Galeazzi M, Marcolongo R (2005) Diagnosis of calcium pyrophosphate dihydrate crystal deposition disease: ultrasonographic criteria proposed. Ann Rheum Dis 64:638-640.
- Slatkowsky-Christensen B, Mowinckel P, Loge JH, Kvien TK (2007) Health-related quality of life in women with symptomatic hand osteoarthritis: a comparison with rheumatoid arthritis patients, healthy controls, and normative data. Arthritis Rheum 57:1404-1409.
- Haugen IK, Englund M, Aliabadi P, Niu J, Clancy M, Kvien TK, Felson DT (2011) Prevalence, incidence and progression of hand osteoarthritis in the general population: the Framingham Osteoarthritis Study. Ann Rheum Dis 70:1581-1586.
- Mathiessen A, Slatkowsky-Christensen B, Kvien TK, Hammer HB, Haugen IK (2016) Ultrasound-detected inflammation predicts radiographic progression in hand osteoarthritis after 5 years. Ann Rheum Dis 75:825-830.
- Hammer HB, Iagnocco A, Mathiessen A, et al. (2016) Global ultrasound assessment of structural lesions in osteoarthritis: a reliability study by the OMERACT ultrasonography group on scoring cartilage and osteophytes in finger joints. Ann Rheum Dis 75:402-407.
- Kortekaas MC, Kwok WY, Reijnierse M, Huizinga TW, Kloppenburg M (2011) Osteophytes and joint space narrowing are independently associated with pain in finger joints in hand osteoarthritis. Ann Rheum Dis 70:1835-1837.
- Keen HI, Wakefield RJ, Grainger AJ, Hensor EM, Emery P, Conaghan PG (2008) Can ultrasonography improve on radiographic assessment in osteoarthritis of the hands? A comparison between radiographic and ultrasonographic detected pathology. Ann Rheum Dis 67:1116-1120.
- Mathiessen A, Haugen IK, Slatkowsky-Christensen B, Bøyesen P, Kvien TK, Hammer HB (2013) Ultrasonographic assessment of osteophytes in 127 patients with hand osteoarthritis: exploring reliability and associations with MRI, radiographs and clinical joint findings. Ann Rheum Dis 72:51-56.
- Klauser AS, Faschingbauer R, Kupferthaler K, Feuchnter G, Wick MC, Jaschke WR, Mur E (2012) Sonographic criteria for therapy follow-up in the course of ultrasound-guided intra-articular injections of hyaluronic acid in hand osteoarthritis. Eur J Radiol 81:1607-1611.
- Weger W (2010) Current status and new developments in the treatment of psoriasis and psoriatic arthritis with biological agents. Br J Pharmacol 160:810-820.
- Finzel S, Sahinbegovic E, Kocijan R, Engelke K, Englbrecht M, Schett G (2014) Inflammatory bone spur formation in psoriatic arthritis is different from bone spur formation in hand osteoarthritis. Arthritis Rheumatol 66:2968-2975.
- Zhang W, Nuki G, Moskowitz RW, et al. (2010) OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage 18:476-499.
- McGarry JG, Daruwalla ZJ (2011) The efficacy, accuracy and complications of corticosteroid injections of the knee joint. Knee Surg Sports Traumatol Arthrosc 19:1649-1654.
- Bellamy N, Campbell J, Robinson V, Gee T, Bourne R, Wells G (2006) Intraarticular corticosteroid for treatment of osteoarthritis of the knee. Cochrane Database Syst Rev CD005328.
- Iagnocco A, Naredo E (2010) Ultrasound-guided corticosteroid injection in rheumatology: accuracy or efficacy? Rheumatology (Oxford) 49:1427-1428.
- Epis O, Iagnocco A, Meenagh G, et al. (2008) Ultrasound imaging for the rheumatologist. XVI. Ultrasound-guided procedures. Clin Exp Rheumatol 26:515-518.
- Berkoff DJ, Miller LE, Block JE (2012) Clinical utility of ultrasound guidance for intra-articular knee injections: a review. Clin Interv Aging 7:89-95.
