FIBROMIALGIA: EPIDEMIOLOGIA, INQUADRAMENTO CLINICO E CRITERI DIAGNOSTICI
AUTORI:
1Fausto Salaffi,1Sonia Farah
Definizione
La fibromialgia (FM) è definita come “una sindrome da sensibilizzazione centrale caratterizzata dalla disfunzione dei neurocircuiti preposti alla percezione, trasmissione e processazione delle afferenze nocicettive, con prevalente estrinsecazione del dolore a livello dell’apparato muscoloscheletrico”.
Oltre al dolore possono essere presenti molteplici sintomi di accompagnamento, comuni ad altre sindromi algo-disfunzionali (Talotta R, et al. Clin Exp Rheumatol. 2015)
Tale sovrapposizione di segni e sintomi clinici con altre sindromi, quali il colon irritabile, i disturbi somatoformi, la cefalea muscolo-tensiva, la dismenorrea primaria, la sindrome da fatica cronica, la sindrome del colon irritabile, le algie faciali atipiche, etc. rendono, talvolta, difficile classificarla come un’entità clinica a sé stante. Appare corretto dunque, includere la FM nell’ambito delle “sindromi da sensibilizzazione centrale” (Figura 1) facendo riferimento, con questa definizione, al principale meccanismo patogenetico (alterazione del sistema nocicettivo) identificato come causa principale della sintomatologia, scheletrica ed extra-scheletrica.
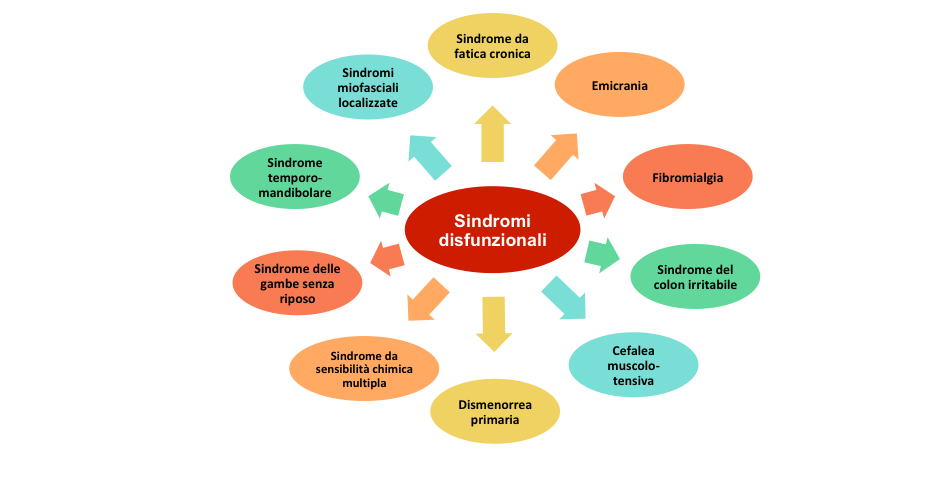
Figura 1: Principali sindromi da sensibilizzazione centrale
Epidemiologia
La FM occupa, per frequenza, il 2°-3° posto tra le malattie reumatiche e rappresenta il 12-20% delle diagnosi formulate in ambito ambulatoriale. La Tabella I riporta il tasso di prevalenza della FM riscontrata in letteratura. I numerosi studi sono difficilmente confrontabili per difformità dei criteri classificativi, per le differenti procedure diagnostiche adottate e delle coorti esaminate. Inoltre, sono spesso invariabilmente impiegate le definizioni di “period prevalence” (prevalenza valutata durante un periodo di mesi o anni) e di “point prevalence” (fotografia istantanea della situazione in un unico momento) senza indicare i periodi di osservazione. La prevalenza della FM nella popolazione generale è, tuttavia, stimabile in una media intorno al 5% (Tabella I). In generale la prevalenza varia nei maschi tra lo 0,1% ed il 3,9% e nelle donne tra il 2,5% ed il 10,5%. Nelle donne cresce con l’aumentare dell’età, fino ai 79 anni. Nel 2005 in Italia Salaffi e coll. hanno condotto lo studio MAPPING (Salaffi F, et al. Clin Exp Rheumatol. 2005) al fine di raccogliere dati sulla prevalenza delle malattie muscoloscheletriche su un campione della popolazione italiana composto da 2.155 pazienti selezionati dai Medici di Medicina Generale. La prevalenza della FM riscontrata è stata pari al 2,22%, che individuerebbe nel nostro Paese, tenuto conto del dato ISTAT sulla popolazione residente in Italia, 1.346.700 pazienti affetti. 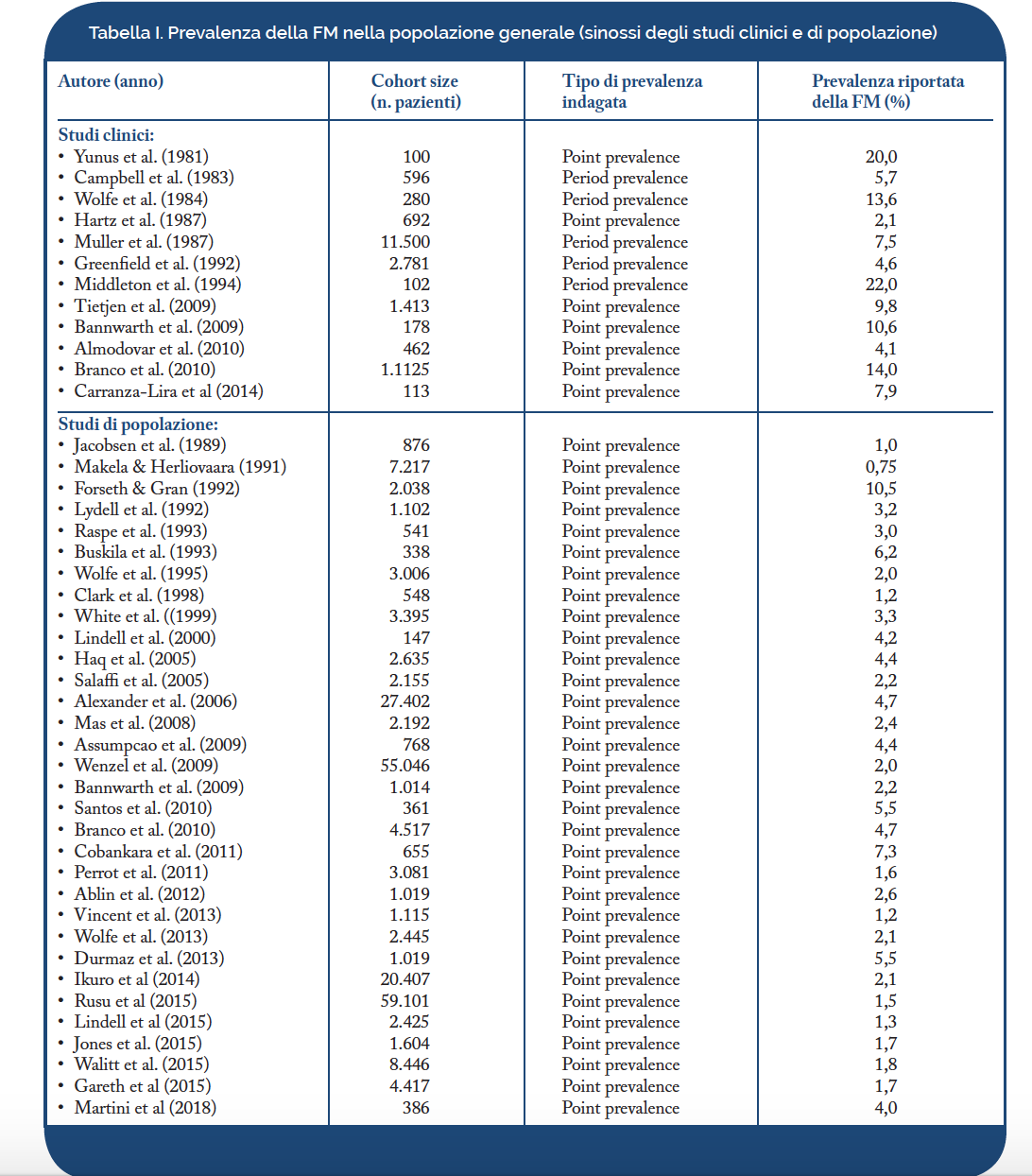
Eziopatogenesi
RUOLO DEL SISTEMA NEUROENDOCRINO
L’eziologia della FM non è nota, ma si ritiene che alterazioni a carico di numerosi neurotrasmettitori e del sistema neuro-endocrino abbiano un ruolo preminente nell’insorgenza della malattia e riguardano la riduzione dei livelli di amine biogene, un’aumentata concentrazione di neurotrasmettitori eccitatori (tra cui la sostanza P) ed una disregolazione dell’asse ipotalamo-ipofisi-surrene (HPA) (Ferraccioli G, et al. J Rheumatol. 1990; Ferraccioli G, et al J Rheumatol. 1994). L’insorgenza e la cronicizzazione della malattia sono riconducibili all’interazione tra un’aberrazione dei meccanismi fisiologici alla base della nocicezione e molteplici fattori psicologici (ad esempio lo stress) ed ambientali (Figura 2) (Lawson K. Neuropsychiatr Dis Treat. 2008). In molti pazienti affetti da FM è presente una riduzione della capacità di modulazione del dolore attraverso le vie discendenti: in particolare sembra compromessa l’attività serotoninergica-noradrenergica. Tale elemento è suffragato dai benefici terapeutici apportati dai farmaci inibitori della ricaptazione della serotonina e della noradrenalina (SNRI). La sensibilizzazione neuronale in diverse aree del sistema nervoso centrale (SNA) rappresenta l’ipotesi patogenetica maggiormente accreditata. Il Corticotropin Release Hormon (CRH) amplifica a livello neurormonale il disagio da stress. Tale neuro-ormone agisce attraverso un meccanismo definito “braccio corto” sul centralino (locus coeruleus) del sistema nervoso vegetativo che, a sua volta, condiziona il funzionamento degli organi e/o dei sistemi (sistema gastro-enterico, cardio-vascolare, ecc.) da esso dipendenti attraverso i suoi due rami: parasimpatico e simpatico. Lo stesso CRH amplifica anche l’allerta neuro-ormonale (“braccio lungo”) nell’ipofisi, provocando il rilascio in circolo dell’ormone adrenocorticotropo (Adreno-Cortico Tropic Hormone – ACTH), che a sua volta incrementa la liberazione dalle ghiandole surrenali dell’adrenalina e del cortisolo (Ferraccioli G, et al. J Rheumatol. 1990). Quest’attivazione dei sistemi dello stress mette in azione il sistema di percezione del dolore, situato nel sistema limbico, riducendo la via discendente inibitoria del dolore. In tale azione sono coinvolte sostanze quali la serotonina, la norepinefrina, le β-endorfine e la sostanza P, la somatomedina C (Ferraccioli G, et al, J Rheumatol. 1994). 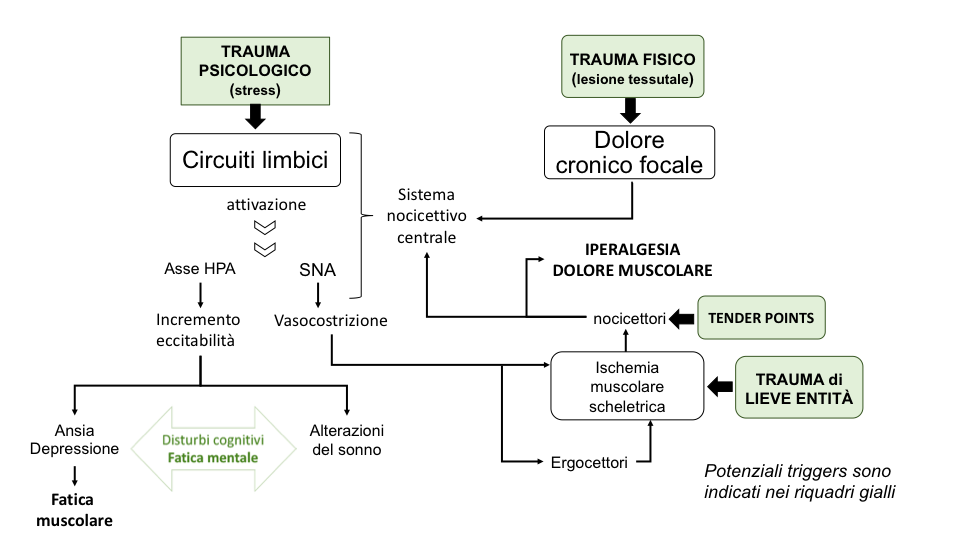 Figura 2: Modello ciclico dei processi fisiopatologici associati alla FM (modificato da: Lawson K. Treatment options and patient perspectives in the management of fibromyalgia: future trends. Neuropsychiatr Dis Treat. 2008;4(6):1059-71).
Figura 2: Modello ciclico dei processi fisiopatologici associati alla FM (modificato da: Lawson K. Treatment options and patient perspectives in the management of fibromyalgia: future trends. Neuropsychiatr Dis Treat. 2008;4(6):1059-71).
RUOLO DELLA NEUROINFIAMMAZIONE
Crescenti evidenze suggeriscono che la neuroinfiammazione possa rappresentare una delle cause alla base di molte malattie del SNC tra cui la FM. La così detta “attivazione gliale” sta emergendo come meccanismo chiave che sta alla base della genesi e nella modulazione del dolore cronico in corso di FM. L’attivazione delle cellule di Schwann nel nervo (Kadetoff D, et al. J Neuroimmunol. 2012), delle cellule gliali satelliti nei gangli e nella microglia, ed astrociti ed oligodendrociti nel midollo spinale e nel cervello, è sostenuta da citochine pro-infiammatorie (TNF, IL-1β,IL-6, IL-8 e IL-18) e chemochine, ma anche oppioidi, attraverso l’attivazione del “Toll-like receptor 4” o TLR-4, recentemente scoperto sulle cellule macrofagiche e della microglia, come elemento concorrente al dolore cronico (Watkins LR, et al. Trends Pharmacol Sci. 2009). È dimostrato che il TLR4, espresso nel midollo spinale, media la transizione dell’ipersensibilità meccanica da acuta a persistente dopo la risoluzione dell’infiammazione in un modello di artrite nei roditori. Il tumor necrosis factor-alpha (TNF-α) è una delle citochine infiammatorie più studiate e più potenti ed è espressa da microglia, astrociti e neuroni sensitivi primari. Tuttavia, PCR-analisi di singole cellule rivela che nonostante la maggioranza della microglia (90%) ed alcuni astrociti (40%) esprimano TNF-α, i neuroni del midollo spinale non lo fanno, suggerendo che la microglia possa essere la sorgente maggiore di TNF-α nel midollo spinale. È noto che la neutralizzazione del TNF-α agisce sull’inibizione del dolore in maniera più rapida rispetto alla riduzione dei segni di flogosi, quali la tumefazione articolare. L’effetto analgesico si esplicherebbe presumibilmente attraverso l’inibizione della neurotrasmissione nocicettiva mediata dal TNF-α (plasticità sinaptica) nelle corna dorsali del midollo spinale, prima che si evidenzi un miglioramento dell’infiammazione. L’interleuchina-1 beta (IL-1β), un’altra citochina infiammatoria, è espressa sia dalla microglia che dagli astrociti nel midollo spinale, mentre l’IL-18 – che è strettamente correlata all’IL-1β – è indotta nella microglia dopo danno ai nervi ed esposizione cronica agli oppioidi. Le chemochine come CCL2, CCR2, CXCL1 e CCL7 sono prodotte dagli astrociti del midollo spinale e facilitano il dolore neuropatico. In particolare CCL2 e CCR2 sono coinvolti nelle interazioni di segnale tra i neuroni sensitivi primari e la microglia del midollo spinale nel dolore neuropatico. Il CCR2 è probabilmente il recettore delle chemochine maggiormente studiato nella ricerca sul dolore. Il basic fibroblast growth factor (bFGF) è indotto negli astrociti del midollo spinale per sostenere il dolore neuropatico. Inoltre, le cellule gliali producono citochine antinfiammatorie come IL-4, IL-10, TGF-β ed IFN-α che antagonizzano il dolore, ma la localizzazione cellulare di queste citochine antinfiammatorie non è ben caratterizzata. È stato, inoltre, evidenziato come i livelli di glutammato risultino aumentati nel liquido cerebrospinale e alla risonanza magnetica spettroscopica cerebrale dei pazienti con FM, mentre i livelli di acido gamma aminobutirrico (GABA) siano diminuiti (Harris RE, et al. Arthritis Rheum. 2009 – Foerster BR, et al. Arthritis Rheum. 2012). L’azione della corteccia anteriore del cingolo sulla modulazione del dolore non è ancora del tutto chiarita, ma si suppone che il rilascio di neuro-trasmettitori inibitori come GABA e gli oppioidi, riduca l’eccitabilità dei neuroni di questa regione, i quali sono responsabili della modulazione discendente del dolore, agendo sui neuroni del midollo rostrale ventro-mediale (Petrovic P, et al. Science. 2002). E’ anche coinvolto il meccanismo della sommazione temporale del dolore (o “windup”), sostenuto dalla ripetitiva stimolazione delle fibre nocicettive (Littlejohn G. Nat Rev Rheumatol. 2015). Vari studi che hanno impiegato la tomoscintigrafia cerebrale perfusionale (SPECT) e la risonanza magnetica funzionale (fMRI) hanno evidenziato anormalità perfusionali rispetto ai controlli, con un’attività elevata nella corteccia somato-sensoriale e ridotta nella corteccia frontale, nel cingolo, nella corteccia temporale e cerebellare (Guedj E, et al. Eur J Nucl Med Mol Imaging. 2007 – Gracely RH, et al. Arthritis Rheum. 2002 – Feraco P, et al. AJNR Am J Neuroradiol. 2011). Le ipotesi finora descritte suggeriscono che vi sarebbe anche un’alterazione dei pathways del dolore nel SNC, mentre secondo altri studi la FM sarebbe sostenuta da un’infiammazione delle piccole fibre periferiche (Uceyler N, et al Brain. 2013 – de Tommaso M,et al. J Neurol. 2014). L’iperattività dei neuroni sensitivi primari aumenterà il rilascio di neurotrasmettitori (per es., glutammato) e neuromodulatori come sostanza P, calcitonin gene-related peptide (CGRP) e brain-derived neurotrophic factor (BDNF) dai terminali centrali di afferenti primari nel midollo spinale e nel nucleo trigeminale, che causano iperattività di neuroni nocicettivi postsinaptici, cioè sensibilizzazione centrale. La sensibilizzazione centrale è responsabile del dolore secondario al di fuori del sito iniziale di danno. L’attivazione dei recettori NMDA e di mitogen activated protein-kinase ha un ruolo importante nella sensibilizzazione centrale e nell’ipersensibilità al dolore.
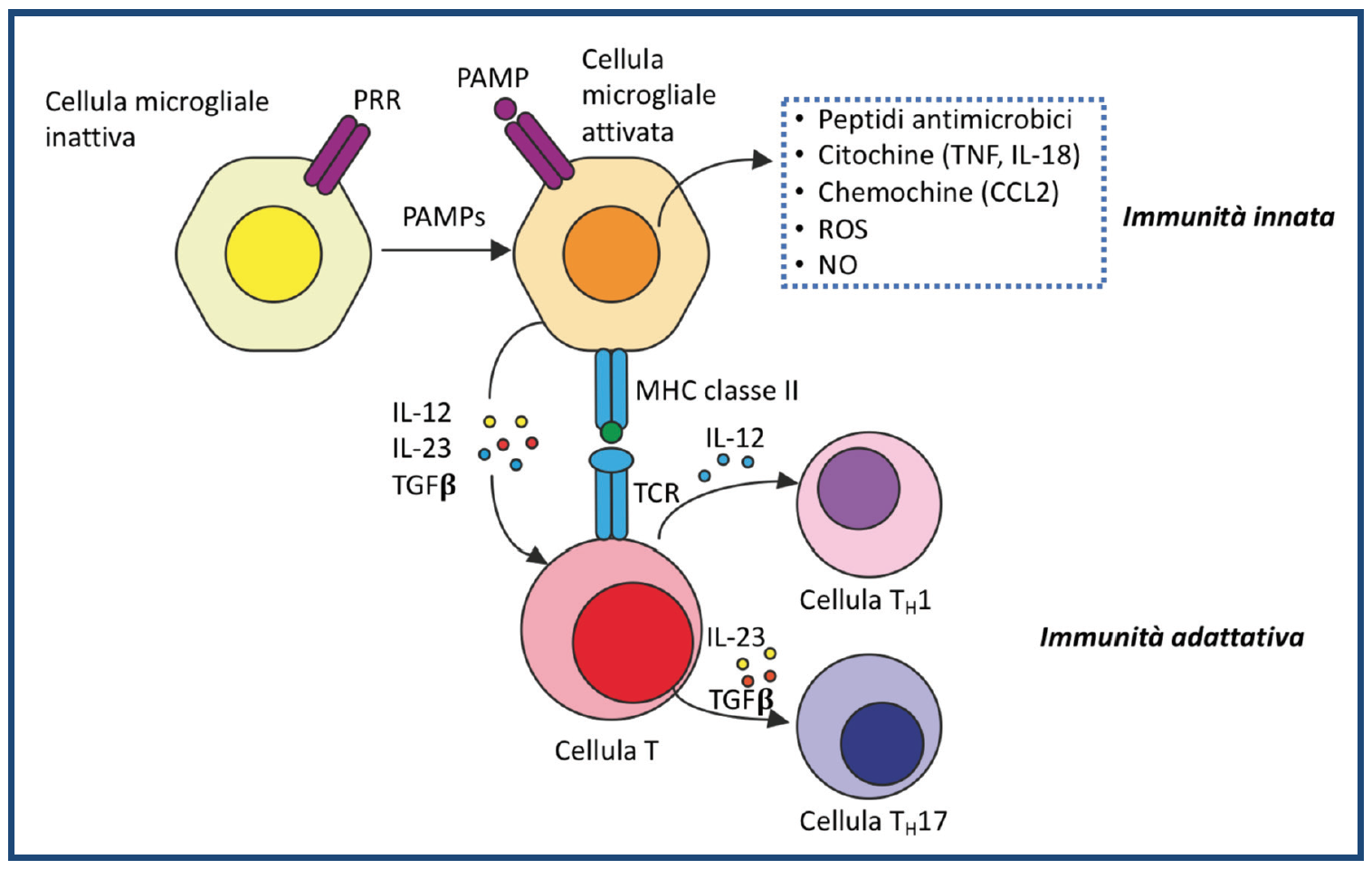
Figura 3: La neuroinfiammazione nel midollo spinale guida il dolore cronico attraverso interazioni neurono-gliali (mediati da PAMPs) e meccanismi di sensibilizzazione centrale. La neuroinfiammazione è caratterizzata dall’attivazione della microglia e degli astrociti, da infiltrazione di cellule immuni nel SNP e nel SNC (per es., nel midollo spinale), e dalla produzione di mediatori gliali ed infiammatori come le citochine e le chemochine proinfiammatorie, radicali liberi dell’ossigeno (ROS), fattori di crescita e gliotrasmettitori (glutammato ed ATP). Questi mediatori gliali possono modulare potentemente la trasmissione sinaptica eccitatoria ed inibitoria, determinando una sensibilizzazione centrale e stati aumentati di dolore cronico. I mediatori gliali possono ulteriormente agire sulla glia e sulle cellule immuni per facilitare la neuroinfiammazione attraverso vie autocrine e paracrine.
RUOLO DEI FATTORI GENETICI
La documentata predisposizione familiare alla FM ha contribuito a considerare la presenza di geni specifici potenzialmente associati ad un maggiore rischio di FM. Alcuni studi hanno evidenziato una maggiore frequenza di alterazioni genetiche nella FM, come il polimorfismo del recettore della serotonina 5-HT2A, il fenotipo T/T, il trasportatore di serotonina, il recettore della dopamina 4 ed i polimorfismi COMT (Catecolamina O-Metil-Transferasidasi) (Buskila D, et al. Pharmacogenomics. 2007). Il gene COMT codifica un enzima che metabolizza le catecolammine (noradrenalina e dopamina) ed influenza numerose modalità di percezione e sensibilità di dolore. Ulteriori studi hanno identificato altri bersagli quali la regione del cromosoma 17p11.2-q11.2 o significative differenze nelle frequenze alleliche in tre geni: GABRB3 (rs4906906902, p = 3.65x10(-6)), TAAR1 (rs8192619191919, p = 1.11x10(-5)) e GBP1 (rs7911, p = 1.06x10(-4). Vi sono anche prove emergenti di polimorfismi genetici funzionali che influenzano la gravità del dolore in FM (Kosek E, et al. Brain Behav Immun. 2016).
Fattori scatenanti
Sebbene l’eziologia della FM non sia ancora del tutto nota, si ritiene che alla sua origine concorrano fattori esterni scatenanti, quali lo stress, altre malattie concomitanti ed una varietà di condizioni dolorose croniche concomitanti. (Stisi S, et al. Reumatismo. 2008). Fra i possibili fattori scatenanti (o trigger) la FM si possono includere:
- Stressors prenatali, nell’infanzia e nell’adolescenza. Nell’uomo l’assunzione materna di cortisone, deficit nutrizionali o l’esposizione a traumi psicofisici durante la gravidanza sarebbero in grado di alterare lo sviluppo dell’asse HPA nel feto. Il basso peso alla nascita è correlato, sia con l’iperattività dell’asse HPA nel maschio, sia con l’ipertono simpatico nella femmina. Esperienze traumatiche (abusi, abbandono, gravi malattie nell’infanzia) determinano una maggiore frequenza di alcune condizioni morbose, quali la depressione maggiore e la FM nell’età adulta. È probabile che la reazione allo stress indotta da questi eventi traumatici, verificatisi in un periodo critico per lo sviluppo di neurocircuiti specifici, induca alterazioni persistenti a carico del sistema nervoso centrale (SNC) (Figura 2).
- Disturbo post-traumatico da stress: esperienze traumatiche ambientali particolarmente gravi, come attacchi terroristici o disastri naturali quali i terremoti (Salaffi F, et al. Clin Exp Rheumatol. 2017) o la sommazione di più eventi hanno determinato un incremento, nella popolazione di disturbi post-traumatici da stress e l’aggravamento dei sintomi della FM. Sebbene il trauma da stress derivi da eventi esterni, un ruolo fondamentale è riconducibile alle modalità di come vengono affrontati e superati i problemi che si presentano. Infatti, possono spesso concomitare turbe del carattere o psico-patologie (disturbo d’ansia o depressione, disturbo di panico e fobie, ecc.) che generano difficolta di “problem solving” anche nei confronti delle semplici difficoltà di vita quotidiana (Ercolani M, et al. Psychother Psychosom. 1994). In sostanza, si ritiene che lo stress psicologico derivi dall’errata percezione delle sfide ambientali da parte dell’individuo, che vengono vissute come eccessivamente difficili da affrontare e potenzialmente in grado di mettere a rischio il proprio benessere. Lo stress, in questo senso, diviene un trigger dannoso, capace di innescare una condizione di allarme, instillare senso di precarietà e percezione di diminuito benessere e, parallelamente, si riducono le strategie di coping del soggetto.
- Disturbi del sonno. Indagini elettroencefalografiche, hanno documentato la spontanea comparsa di onde alfa, cioè di onde associate alla reazione di risveglio, entro il ritmo ad onde lente delta che caratterizza il sonno profondo (fase non-REM). Tali alterazioni potrebbero, tuttavia, rappresentare, non la causa della FM, bensì la conseguenza di alterazioni neuro-endocrine ed immunologiche indotte da infezioni batteriche o virali, da traumi fisici o psichici o, più in generale, dalla reazione cronica da stress.
- Disturbi psicologici. La depressione e l’ansia sono un denominatore comune delle condizioni dolorose croniche, specie della FM (Ercolani M, et al. Psychother Psychosom. 1994). Il rapporto tra dolore e depressione sembra essere bidirezionale, anche se gli studi effettuati nei pazienti con FM un nesso di causalità tra sindromi depressivi e l’insorgenza della malattia non è mai stato provato. In particolare, tra i pazienti con FM è frequente la comorbidità con le crisi di panico e con il disturbo fobico-ossessivo.
- Alterazioni ormonali. La constatazione che la FM è più frequente nel sesso femminile ha fatto ipotizzare un ruolo patogenetico degli ormoni sessuali. La reattività dell’HPA e del sistema nervoso autonomo, rispetto all’uomo, è minore nella donna dalla pubertà alla menopausa, mentre tende ad aumentare dopo la menopausa per il venir meno della stimolazione ormonale (Ferraccioli G, et al. J Rheumatol. 1990). La condizione estrogenica, quindi, non interverrebbe in modo diretto sull’insorgenza del dolore cronico muscoloscheletrico, quanto sulla reattività di entrambi gli effettori del sistema di reazione allo stress a stimoli traumatici esterni. L’ipotiroidismo, clinicamente manifesto, può mimare la sintomatologia muscoloscheletrica della FM, entrando in diagnosi differenziale con essa.
- Ipersensibilità a sostanze chimiche multiple. Una particolare sensibilità a molteplici sostanze chimiche presenti nell’ambiente sarebbe alla base della sindrome da Sensibilità Chimica Multipla (Multiple Chemical Sensitivity – MCS). Si tratta di una patologia immuno-neurotossica strettamente connessa all’inquinamento ambientale che può condurre allo sviluppo di una condizione clinica strettamente embricata con i meccanismi algodisfunzionali centrali che può comportare svariati sintomi respiratori, gastrointrestinali, endocrini, ginecologici, neurologici ed anche psichici.
- Infezioni. Le osservazioni cliniche circa l’insorgenza della FM, in una quota di pazienti, a seguito di malattie febbrili, ha indotto a ricercare il possibile ruolo di uno o più agenti infettivi nell’eziopatogenesi della malattia. Infezioni da virus dell’epatite C (HCV), virus di Epstein-Barr o parvovirus, brucellosi e malattia di Lyme sono spesso indicate come le infezioni con decorso prolungato che fungono da innesco. Sebbene un rapporto di causalità diretta tra malattie infettive e FM non sia stato dimostrato, sembra tuttavia plausibile che le infezioni possano agire da agente scatenante. È probabile che l’ipotetico agente infettivo, naturale o attenuato, agisca indirettamente stimolando la secrezione di citochine che, a loro volta, interverrebbero nelle molteplici funzioni fisiologiche che sono state trovate alterate nei pazienti con FM.
- Fibromialgia concomitante ad altre malattie reumatologiche. Il rischio di sviluppare la FM sembra essere aumentato nei pazienti affetti da condizioni dolorose croniche di altra natura (Atzeni F, et al. Best Pract Res Clin Rheumatol. 2011 – Häuser W, et al. Clin Exp Rheumatol. 2019). Gli input nocicettivi persistenti (fenomeno del windup del secondo dolore) potrebbero indurre, in soggetti predisposti, l’insorgenza della FM. La FM concomitante ad altre malattie reumatologiche è più comune della forma primitiva ed in particolare risulta associata più comunemente al lupus eritematoso sistemico (LES), alla sindrome di Sjögren (SS) alle spondiloartriti (SpA) ed all’artrite reumatoide (AR) (Di Franco M, et al. Clin Exp Rheumatol. 2011)
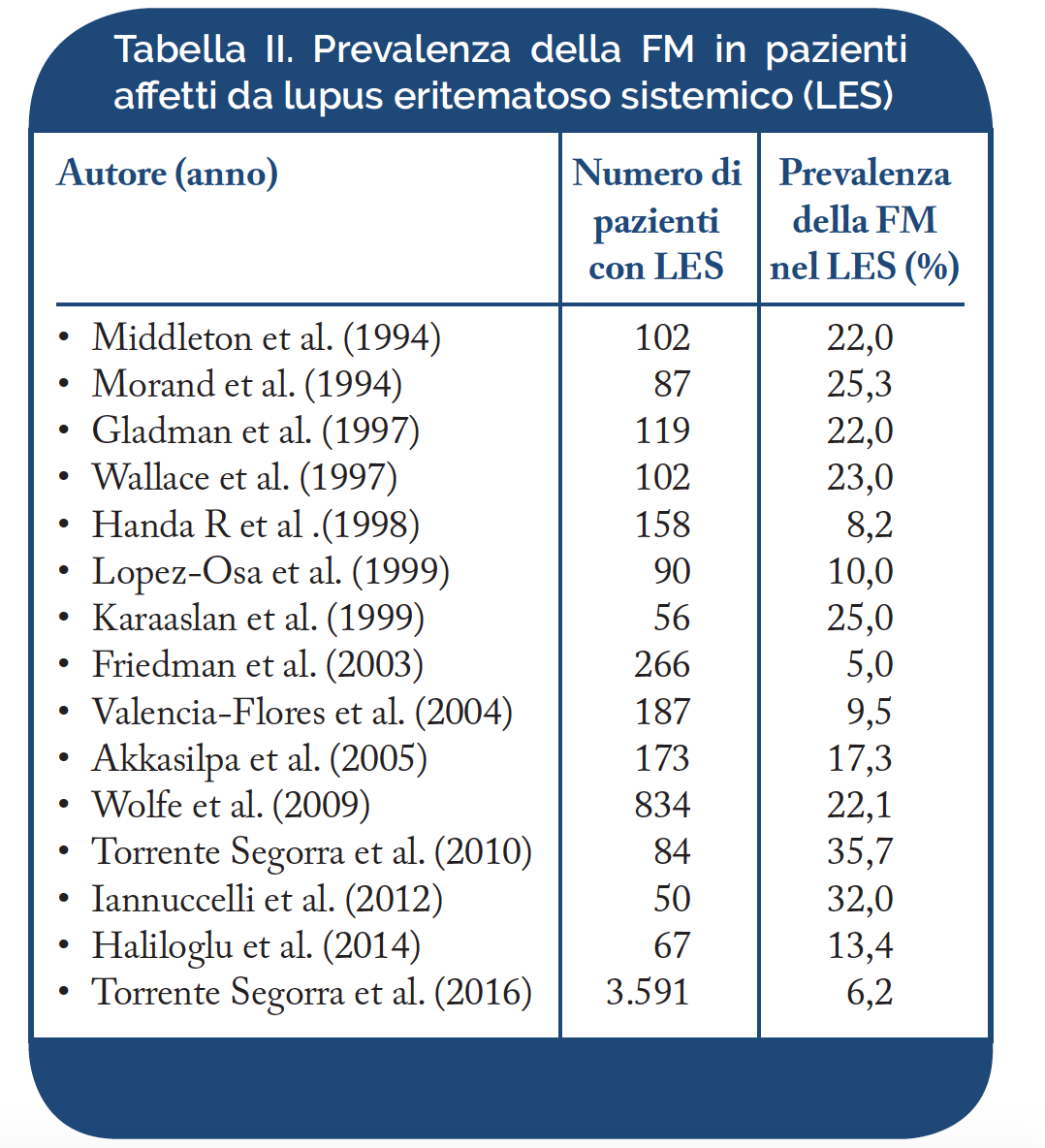
Lupus Eritematoso Sistemico (LES). Nel LES la FM è stata osservata nel 5-35,7% dei pazienti (Tabella II). Oltre l’80% dei pazienti affetti da LES lamenta astenia marcata ed artromialgie diffuse; una percentuale inferiore soffre di disturbi psico-affettivi e cefalea. La diagnosi di FM in un paziente affetto da LES può risultare non facile, data la somiglianza di alcuni sintomi, comuni ad entrambe le malattie. Nei pazienti in cui le due condizioni coesistono, il dolore e l’astenia sono particolarmente intensi e si possono osservare altri disturbi come rigidità articolare, sindrome sicca, fenomeno di Raynaud e depressione. Inoltre, i casi associati a FM presentano un maggiore impatto sullo stato funzionale globale e sulla qualità della vita (Doria A, et al. Rheumatology (Oxford). 2004 – Rinaldi S, et al. Rheumatology (Oxford). 2004). Non è tuttora noto perché la coesistenza di FM determini un peggioramento della qualità di vita nei pazienti affetti da LES, ma si ritiene possa essere condizionata dagli aspetti psico-emozionali. L’elevata frequenza dell’associazione tra LES e FM suggerisce l’esistenza di possibili meccanismi patogenetici comuni alla base di sintomi, quali dolore, ansia e depressione. Sebbene il dolore e l’astenia siano correlati ai livelli di anticorpi anti-polimerasi nei pazienti con FM, non vi è sufficiente evidenza che tali manifestazioni siano di origine autoimmune in questa malattia. Recenti osservazioni suggeriscono come, in entrambe le malattie, possano essere coinvolti i recettori NMDA (N-Metil-D-Aspartato) ed i recettori per la neurokinina-1 (NK-1) che rappresentano i mediatori dell’ipereccitabilità nervosa centrale, possibile causa di iperalgesia. Il coinvolgimento di questi recettori, mediato da meccanismi autoimmuni o di altra natura, potrebbe essere alla base dei disturbi dell’umore e dello stato di dolore cronico, registrato sia nel LES che nella FM. Il trattamento dei pazienti affetti da LES o FM con inibitori dei recettori NMDA e delle neurokinine sembra prevenire o alleviare il dolore cronico ed i disturbi della sfera cognitiva (Staud R. Curr Rheumatol Rep 2006).
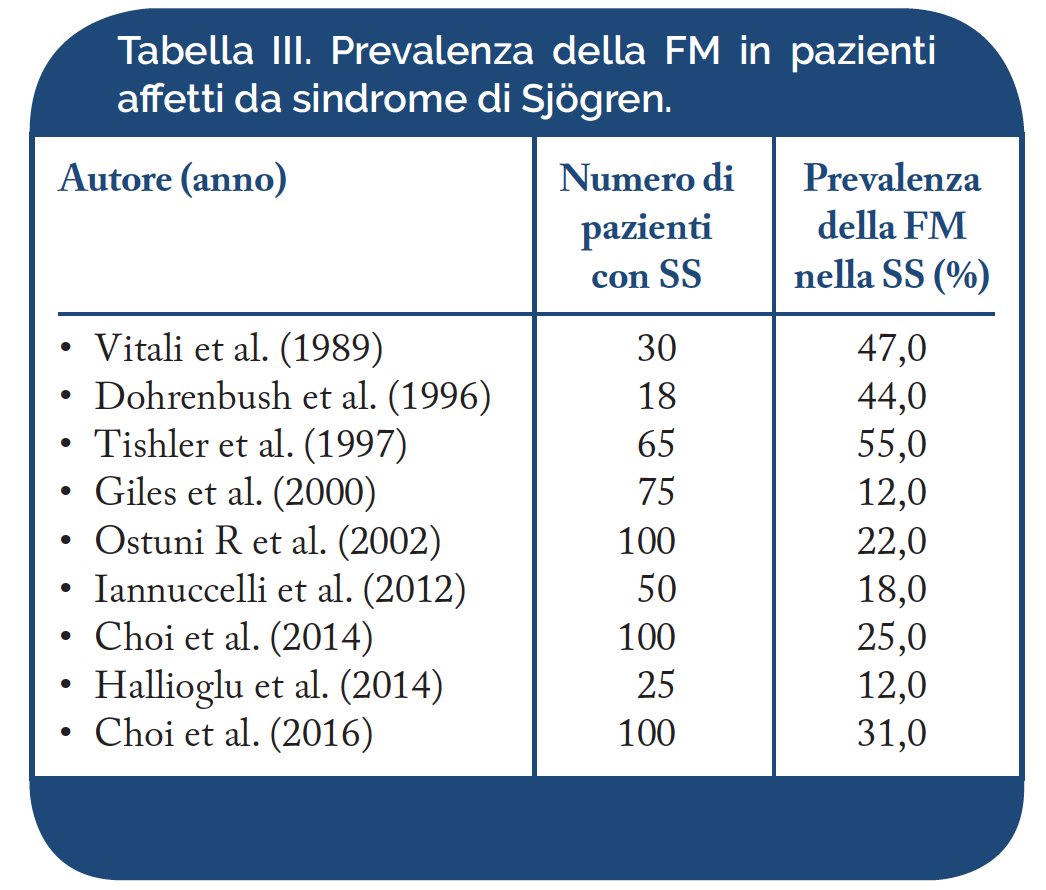
Sindrome di Sjögren (SS). La prevalenza della FS associata a SS è stata riportata dal 12% al 55% (Tabella III). Il quadro clinico della SS comprende, oltre ai sintomi secondari al coinvolgimento delle ghiandole esocrine, manifestazioni extra-ghiandolari, quali le artromialgie e l’astenia, o sintomi correlati all’impegno d’organo, come la cefalea, i disturbi del sonno e dell’umore (ansia e depressione), la vasculite cutanea, la mononeurite multipla, la polmonite interstiziale e la nefrite interstiziale. La patogenesi delle manifestazioni extraghiandolari non è nota e si ritiene che tali disturbi siano, in parte, di origine algo-disfunzionale. I disturbi dell’umore, come l’ansia e la depressione, si osservano nel 10-40% dei casi di SS e secondo alcuni autori sono secondari all’impegno vasculitico del sistema nervoso centrale (SNC), mentre secondo altri autori rappresentano disturbi da somatizzazione. Anche l’astenia e le turbe del sonno potrebbero essere causate dal coinvolgimento vasculitico del SNC o dal rilascio di IL- 1 o altre citochine a livello del SNC. Nella FM sono frequenti l’astenia, i disturbi del sonno ed alcuni sintomi caratteristici della SS come la xerostomia e la xeroftalmia. È stato ipotizzato che molti di questi disturbi possano essere correlati alla depressione/ansia, ad alterazioni del ritmo sonno-veglia, al coinvolgimento organico del SNC o ad alterazioni dell’asse ipotalamo-ipofisi-surrene (Giles I, et al. Ann Rheum Dis 2000).
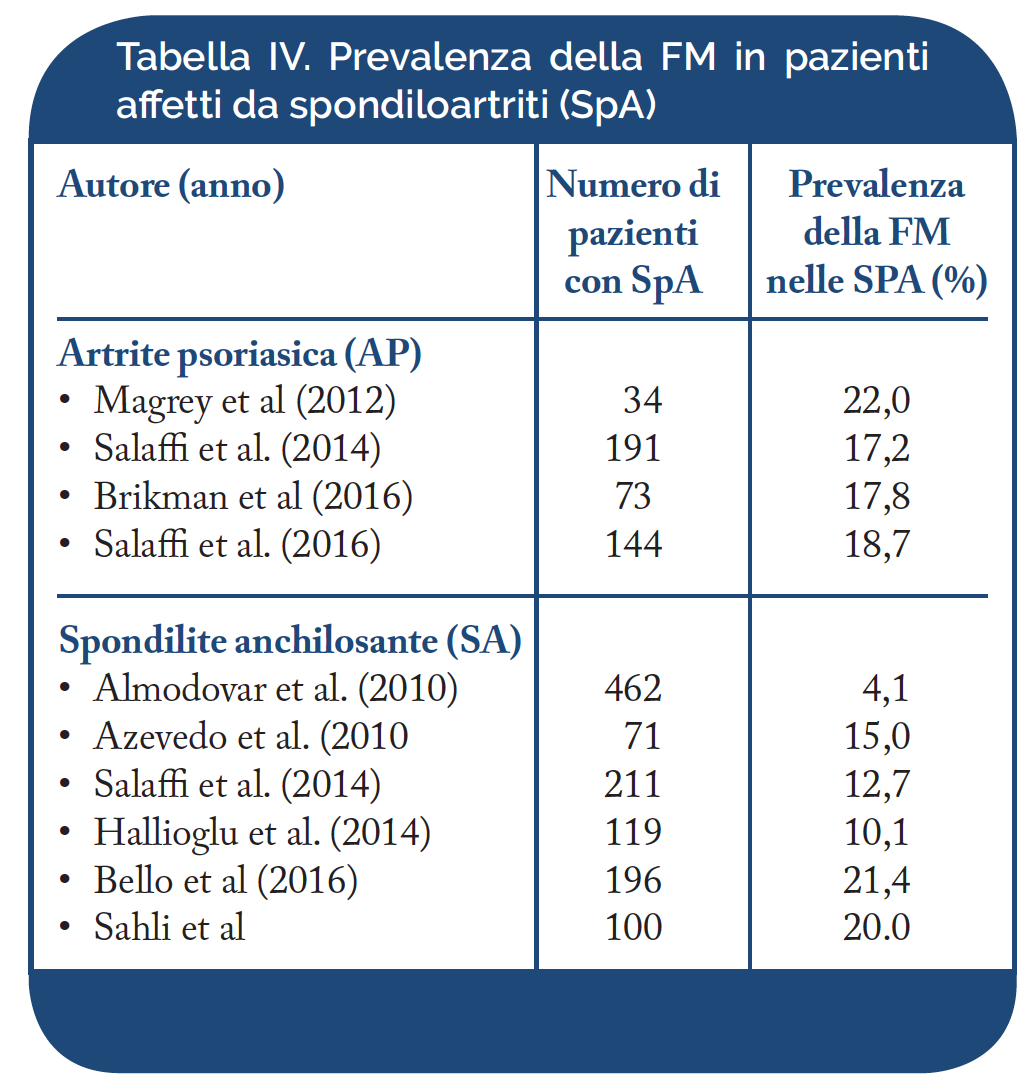
Spondiloartriti (SpA). Il termine di SpA è stato introdotto per definire un gruppo di malattie reumatiche infiammatorie ad andamento cronico classificate tra le affezioni su base immunitaria (Immune-Mediated Infiammatory Disease). Attualmente, nell’adulto, le SpA vengono suddivise in cinque sottotipi principali: la spondilite anchilosante (SA), l’artrite psoriasica (AP), le spondiloartriti reattive, le spondiloartriti enteropatiche (associate a malattie infiammatorie croniche intestinali, quali la colite ulcerosa e la malattia di Crohn) e le spondiloartriti indifferenziate. In Italia, la prevalenza delle SpA è stimata nell’ordine dell’1% (Salaffi F, et al. Clin Exp Rheumatol. 2005 – De Angelis R, et al. Scand J Rheumatol. 2007). La prevalenza della FM nelle SpA, riportata nei diversi studi clinici ed epidemiologici è compresa fra il 17,2% ed il 22,0% per l’artrite psoriasica (AP) ed il 4,1% ed il 50% per la spondilite anchilosante (SA) (Tabella IV). Tali differenze possono essere ascrivibili ai diversi criteri utilizzati per classificare e diagnosticare le SpA. Nella nostra esperienza, in una coorte di 402 pazienti affetti da SpA ad interessamento assiale (axial-SpA), abbiamo osservato una prevalenza di FM del 14.9%; fra le donne la percentuale di FM è risultata pari al 34.2 % e negli uomini pari al 6.1 %. Nei pazienti con AP, la FM è risultata più frequente (17,2% vs. 12,7%). Analogamente ai pazienti con AR, la coesistenza di FM nelle SpA ne influenza negativamente la qualità della vita (Salaffi F, et al. Rheumatol Int. 2014).
Artrite reumatoide (AR). La FM è risulta associata all’AR con frequenza compresa tra il 6,6% e il 33,3% (Tabella V). I pazienti affetti da AR associata con FM differiscono per numerosi aspetti da quelli con sola AR (Salaffi F, et al. Curr Rheumatol Rev. 2018). Attività di malattia, intensità del dolore, compromissione funzionale, strategie di coping, ansia e depressione, sono solo alcune delle possibili differenze (Sarzi-Puttini P, et al. Reumatismo. 2014). È stata riportata una maggiore severità clinica dell’AR associata a FM in termini, sia di compromissione della funzione fisica che della qualità della vita (Salaffi F, et al. Clin Exp Rheumatol. 2009) ed una ridotta capacità a raggiungere la remissione clinica (Salaffi F, et al Rheumatol Int. 2017).

Sintomi
La FM non presenta segni, ma piuttosto una serie di sintomi (Salaffi F, et al. Reumatismo. 2012). I principali sono il dolore diffuso, la rigidità, l’affaticamento e l’astenia, i disturbi intestinali/urogenitali, i disturbi del sistema nervoso centrale e neurocognitivi ed il sonno non riposante (Figura 3) (Salaffi F, et al. J Pain Res. 2016 ). Ve ne sono poi altri meno frequenti come la sensazione di tumefazione dei tessuti molli, le parestesie/disestesie agli arti, la cefalea, i disturbi neuroviscerali e psicologici, la sindrome sicca (Cazzola M, et al. Reumatismo. 2008). Questa proteiforme sintomatologia può essere modulata dalle variazioni atmosferiche e dalla temperatura. Nelle giornate fredde, umide e piovose il dolore e la rigidità sono più intensi, mentre la maggior parte dei pazienti riferisce un effetto benefico del caldo. L’inattività e l’iperattività aggravano la sintomatologia, che migliora invece con una moderata attività fisica. Il ruolo dello stress, sia esso fisico che psichico, è noto come fattore di peggioramento sia del dolore sia di tutti i sintomi eventualmente associati ad esso.
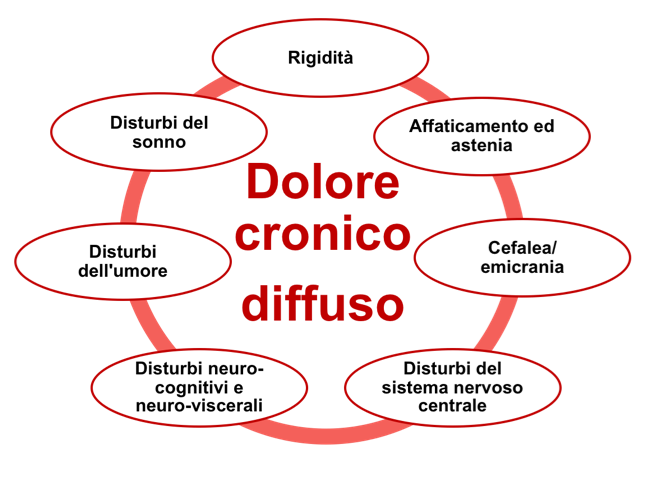
Figura 4: I principali sintomi della FM Dolore cronico diffuso.
Il dolore cronico diffuso che dura da almeno 3 mesi è il sintomo cardine della FM. Viene descritto dal paziente in maniera variegata, come sensazione di bruciore, rigidità, tensione, come un crampo, un taglio, una scossa, una pugnalata, una bruciatura. Causa disabilità al paziente, che, per diminuirne l’intensità, riduce le attività fisiche, quotidiane e lavorative. L’intensità del dolore dei pazienti con FM è risultata superiore a quella dei pazienti con AR, e più disabilitante rispetto alle altre malattie reumatiche, in quanto si accompagna a maggiore disagio psicologico. Il paziente descrive il dolore con espressioni del tipo “mi fa male dappertutto”, oppure “ovunque mi si tocchi, sento male”. Si tratta di un dolore “centrale”, che non ha una localizzazione ed un’entità costanti, ma migra e può aumentare o diminuire durante l’arco della giornata (Salaffi F, et al. Reumatismo. 2005). I pazienti percepiscono come dolorosi anche stimoli esterni solitamente innocui, come il tocco o indossare dei vestiti. Tali caratteristiche sono inquadrabili in un’allodinia (percezione di dolore a seguito di uno stimolo innocuo) ed in un’iperalgesia (aumentata sensibilità al dolore, che si manifesta in caso di stimoli lievi) (Sarzi-Puttini P, et al. Reumatismo. 2014 2). Queste caratteristiche sono proprie del “dolore centrale”, diverse da quelle di un “dolore periferico” di natura meccanica o infiammatoria, in cui sia la localizzazione che l’intensità sono molto più costanti (Salaffi F, et al. Pain Res Manag. 2018). Tali caratteristiche e la frequente localizzazione al rachide (Figura 4) possono rendere difficoltosa la diagnosi differenziale con il dolore infiammatorio, tipico dei pazienti affetti da SpA (axial-SpA), soprattutto tra le donne (Di Franco M, et al. Clin Exp Rheumatol. 2011 – Salaffi F, et al. J Pain Res. 2016).
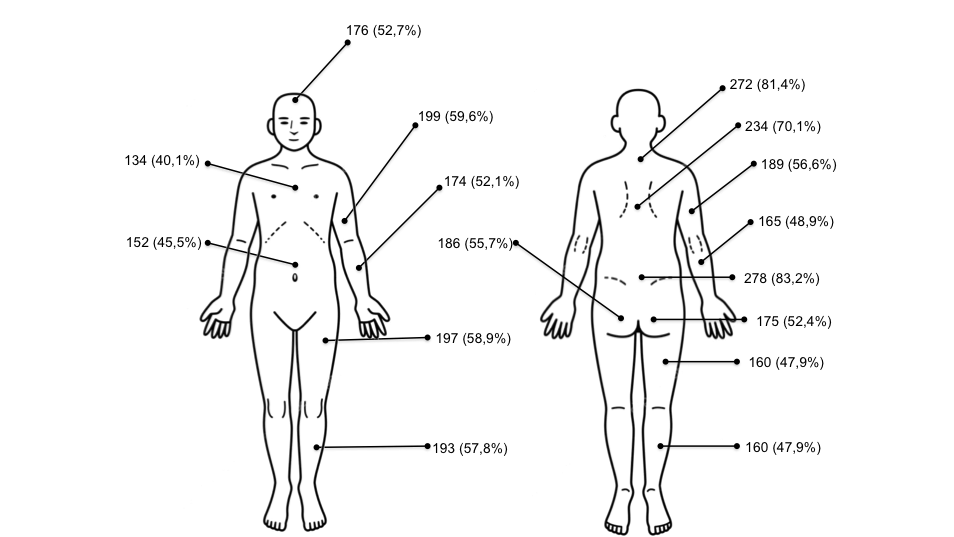
Figura 5: Localizzazione percentuale delle sedi dolorose nei pazienti con FM (da: Salaffi F, et al. J Pain Res. 2016).
Rigidità. Il dolore si accompagna molto frequentemente a rigidità (84-91% dei casi), in genere inferiore a 30 minuti, generalizzata o localizzata al tronco, che si presenta soprattutto al risveglio (rigidità mattutina) o in seguito al mantenimento prolungato della stessa posizione, ma anche la sera dopo una giornata lavorativa. Alcuni fattori esterni, come il microclima e l’umidità, possono peggiorarla.
Affaticamento ed astenia. L’affaticamento e l’astenia sono sintomi riferiti dal 75% al 90% dei pazienti con FM, che spesso possono divenire predominanti ed essere percepiti come prevalenti rispetto alla sintomatologia dolorosa. La ridotta resistenza alla fatica, la stanchezza e la debolezza possono aggravarsi fino all’estrema difficoltà a svolgere qualsiasi movimento (pazienti allettati). Le conseguenze rilevanti sono la forte difficoltà a compiere le normali attività quotidiane, ma interessano anche le sfere intellettuale, affettiva e psicologica. L’astenia dei pazienti con FM è del tutto simile a quella riscontrabile in una patologia denominata “sindrome da affaticamento cronico”, finora ritenuta una diversa entità. In realtà le due sindromi spesso si sovrappongono e può essere impossibile distinguerle.
Cefalea/emicrania. La cefalea, soprattutto nucale, muscolo-tensiva, ma anche quelle temporale, sovraorbitaria, mascellare o mandibolare, oppure l’emicrania, sono comuni nel paziente fibromialgico. A volte il mal di testa è diffuso a tutto il cuoio capelluto, il cui semplice sfioramento riacutizza in maniera drammatica il dolore. La causa potrebbe essere riconducibile ad una condizione di spasmo muscolare a carico dei muscoli del collo e delle spalle. Nel 30-50% dei casi concomita una sindrome temporo-mandibolare,
Disturbi neurocognitivi. I disturbi cognitivi sono frequentemente presenti in pazienti affetti da FM ed includono la perdita della concentrazione e della capacità di fissare la memoria breve, il rallentamento nei gesti, l’incapacità di svolgere diverse mansioni contemporaneamente, la facile distrazione ed il sovraccarico cognitivo. Molto comuni sono “l’annebbiamento fibromialgico” (denominato fibro-fog) o la semplice sensazione di confusione, il peggioramento delle performance linguistiche, la dislessia quando il paziente è affaticato, la difficoltà di scrittura, di lettura e la matematica, etc. (Torta RG, et al. Clin Exp Rheumatol. 2016). Le funzioni cognitive dei pazienti con FM risultano peggiori rispetto a quelle dei soggetti sani di pari età e simili a quelle di adulti venti anni più anziani, relativamente alla memoria a lungo termine e alla “memoria di lavoro” (working memory). L’aumentata attenzione per le sensazioni provenienti dal proprio corpo, il dolore, la presenza di parestesie/disestesie, descritte come sensazioni di formicolio, di spilli o aghi, la sonnolenza diurna ed il deficit di vigilanza secondari alle alterazioni del sonno e gli effetti indesiderati dei farmaci, sembrano essere la causa più probabile di questi disturbi.
Disturbi neuroviscerali. Sono comunemente osservabili nei pazienti con FM i disturbi gastrointestinali come difficoltà digestive, dolori addominali, alternanza di stipsi e diarrea, che si configurano nella “sindrome dell’intestino irritabile” (Irritable Bowel Syndrome, IBS). Alcuni pazienti riferiscono anche difficoltà di deglutizione, presumibilmente secondarie ad un’alterazione della funzionalità della muscolatura intrinseca dell’esofago. Sono riscontrabili inoltre disturbi urinari, come l’aumento della frequenza delle minzioni o l’urgenza minzionale, in assenza di infezioni delle vie urinarie. Si tratta di sintomi tipici della cistite nella donna e dell’ipertrofia prostatica nell’uomo. Questi disturbi sono classificati come “sindrome della vescica irritabile”. In alcuni casi si può sviluppare una condizione dolorosa infiammatoria cronica della vescica conosciuta come “cistite interstiziale” (dolore, pressione, discomfort percepita a livello vescicale, associata a sintomi del basso tratto urinario). In aggiunta, nelle donne, è stata riscontrata una maggiore prevalenza di casi di disfunzione defecatoria dismenorrea e vulvodinia, condizione patologica definita da un dolore cronico localizzato nell’area vulvare, bruciore, fastidio e irritazione, che comporta difficoltà nei rapporti sessuali (Cassisi G, et al. Reumatismo. 2008).
Disturbi dell’umore. I disturbi dell’umore quali ansia e depressione, ma anche ipocondria e attacchi di panico, sono presenti nel 60% dei pazienti con FM. La loro presenza ha indotto a interpretare la malattia come psicosomatica. In realtà soltanto il 30-40% dei pazienti manifesta un disturbo psicologico significativo. Il più frequente è lo stato d’ansia, riportato nel 13 – 64% dei casi, ma numerose ricerche hanno escluso che la FM possa rappresentare una forma particolare di ipocondria. Spesso concomita una “depressione secondaria”, reattiva allo scadimento generale dello stato di salute. La “catastrofizzazione” rappresenta un comune stile cognitivo presente in corso di FM, che comporta un’amplificazione esagerata degli aspetti emozionali, con una visione pessimistica, che fa considerare il dolore come intollerabile (Lee J, Arthritis Rheumatol. 2018). È descritta una “personalità fibromialgica”, caratterizzata da alcuni tratti come perfezionismo, necessità di ordine e pianificazione, pulizia eccessiva, difficoltà a rilassarsi, ipercontrollo della rabbia, bassa autostima, tendenza all’ipocondria, scarse capacità adattive, tendenza ad adottare il ruolo del malato, pessimismo. Tuttavia, non è agevole differenziare quali tra questi tratti possano considerarsi primari, pre-morbosi e favorenti l’insorgenza della malattia, e quali secondari alla presenza dei sintomi.
Disturbi del sonno. I disturbi del sonno sono pressoché costanti (80-90% dei casi) nei pazienti fibromialgici e comportano l’accentuazione, al momento del risveglio, del dolore e dell’astenia. Oltre alla difficoltà all’addormentamento, il paziente ha un sonno turbato da frequenti risvegli notturni e non ristoratore (Choy EH. Nat Rev Rheumatol. 2015). Talora si associano alterazioni del sonno, quali la “sleep apnea” o la sindrome delle gambe senza riposo (oltre il 30% dei pazienti con FM ne soffre) che si manifesta come una necessità irrefrenabile di muovere continuamente le gambe; mentre in altri casi il movimento degli arti si verifica involontariamente durante il sonno (sindrome dei movimenti periodici degli arti durante il sonno). Il sonno è suddiviso in fasi a movimento rapido (REM) e non-REM (NREM). Quest’ultimo è ulteriormente suddiviso in quattro stadi: leggero (stadio 1), intermedio (stadio 2) e sonno ad onde lente o “slow-wave sleep” (SWS; stadi 3 e 4). Circa il 25% del sonno è speso nella fase REM, il 50% nelle fasi 1 e 2, e il 20% in SWS, con solo il 5% circa è speso nella fase di veglia. Studi polisonnografici hanno evidenziato la presenza di alterazioni nel rapporto tra fase REM (Rapid Eye Movements = movimenti oculari veloci) e non-REM (NREM). È stata considerata specifica della FM la cosiddetta “anomalia alfa-delta” o “α-intrusione” termine usato per descrivere il ritmo prominente “α-frequenza” (7-12 Hz) durante il sonno: non appena raggiunta la fase di sonno “profondo” (caratterizzato da onde delta all’elettroencefalogramma) si assiste ad un brusco ritorno verso il sonno “superficiale” (caratterizzato da onde alfa). Tali alterazioni possono avere ricadute negative sui sintomi tipici della malattia, poiché durante il sonno si verifica la produzione dell’ormone della crescita (GH), che a sua volta induce la sintesi di fattore di crescita insulino-simile (IGF-1), che gioca un ruolo rilevante nella omeostasi muscolare. La fase SWS è ritenuta essenziale per la sensazione di benessere e di ristoro: la frequenza cardiaca, la pressione sanguigna, l’attività simpatica, il consumo di glucosio cerebrale ed i livelli di cortisolo sono diminuiti, mentre l’ormone della crescita viene rilasciato durante questa fase del sonno. Poiché la fase SWS può inibire la trasmissione sinaptica, l’interruzione del sonno con la riduzione della fase SWS potrebbe compromettere l’inibizione del dolore, con conseguente incremento e sensibilizzazione centrale (Figura 5). È interessante notare che l’interruzione della fase SWS conduca non solo ad un aumento generale della sensibilità agli stimoli dolorosi, ma anche ad una sensazione somatica non dolorosa, che potrebbe contribuire alla polisintomatologia della FM (Ablin JN, et al. 2013).
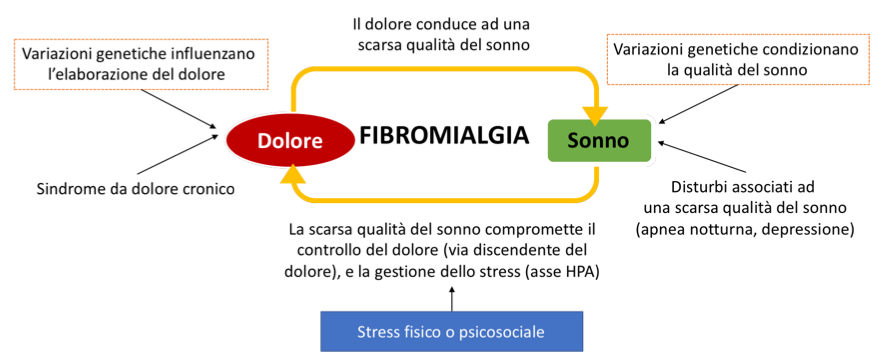
Figura 6: Ruolo ipotetico del sonno nella patogenesi della FM. In questo modello, un rapporto bidirezionale tra sonno e dolore crea un circolo vizioso che può portare alla FM. Abbreviazione: HPA, asse ipotalamo-ipofisi-surrene (Choy EH. Nat Rev Rheumatol. 2015).
Altri sintomi. Possono, inoltre, concomitare disturbi della sensibilità, soprattutto alla vista, al tatto, all’udito e all’olfatto e sono essenzialmente rappresentati da un’eccessiva sensibilità alle stimolazioni esterne, per cui stimoli solitamente ritenuti “confortevoli” possono essere avvertiti come particolarmente intensi. Gli annebbiamenti visivi, la difficoltà di messa a fuoco nello svolgimento di attività di precisione o durante la guida di autoveicoli, determinano, spesso, nausea e capogiri. I disturbi dell’equilibrio consistono in una sensazione d’instabilità, di barcollamento, soprattutto in condizione di stazione eretta prolungata. Le cause possono essere ricondotti a disturbi visivi, contrattura persistente della muscolatura del collo, ipotensione neuro-mediata caratterizzata da sensazione di svenimento, nausea, capogiro, annebbiamento visivo. Costanti sono i disturbi della percezione, quali parestesie a distribuzione non metamerica, sotto forma di formicolii diffusi a tutto il corpo o limitati a un emisoma o agli arti, sensazione di punture di aghi, d’intorpidimento o di “addormentamento” di un arto, sensazione di tumefazione delle mani e dei piedi, sensazioni anomale di freddo o di caldo intenso diffuse a tutto il corpo o agli arti. Talora concomita un’alterata attività vasomotoria, che può aumentare tale disturbo e determinare arrossamento delle mani o vasospasmo da freddo sino a un vero e proprio fenomeno di Raynaud (Salaffi F, et al. Reumatismo. 2012). Tale sintomo è di rilevante interesse poichè può indurre ad una diagnosi erronea di artrite (Di Franco M, et al. Clin Exp Rheumatol. 2011). In alcuni pazienti vengono descritti sintomi “simil-connettivitici”, come la presenza di sindrome sicca (xerostomia e/o xeroftalmia). I fenomeni “allergici”, quali riniti, sinusiti, senso di congestione nasale e sintomi a carico delle basse vie respiratorie, sono riportati più frequentemente dai pazienti FM rispetto ai controlli, anche se, in realtà, si tratta nella quasi totalità dei casi di fenomeni di ipersensibilità scatenati da numerose sostanze presenti nell’ambiente quali il fumo di sigaretta, gli inquinanti ambientali, la polvere, i profumi. Quando le sostanze in grado di indurre queste reazioni sono molteplici, si parla di “Sindrome da Sensibilità Chimica Multipla” (Multiple Chemical Sensitivity – MCS). La MCS viene definita dal National Institute of Environmental Health Sciences statunitense come una malattia caratterizzata dalla inpossibilità di tollerare un certo ambiente chimico o una classe di sostanze generalmente tollerate dalla popolazione sana. Il mercurio, il nichel, diversi pesticidi ed il silicone, utilizzato nelle protesi mammarie, sono le sostanze più frequentemente incriminate come possibile causa di MCS. Si tratta di una patologia tuttora controversa, strettamente connessa all’inquinamento ambientale che può condurre allo sviluppo di una condizione neurotossica strettamente embricata con i meccanismi algo-disfunzionali centrali e che può comportare svariati sintomi: respiratori, gastrointrestinali, endocrini, ginecologici, neurologici ed anche psichici. Secondo la Classificazione Internazionale la MCS è identificata con il codice ICD10 J68.9: “intolleranza a xenobiotici ambientali”, classificabile come “disturbo respiratorio non specificato in relazione all’esposizione ad agenti chimici, gas, fumi, vapori”.
Criteri diagnostici della FM
È di intuibile l’importanza di una diagnosi precoce che eviti non solo l’aggravamento dei sintomi della FM, ma anche l’instaurarsi di circoli viziosi come dolore-disturbi dell’umore, dolore-immobilità, che ne rendono complessa la gestione. La combinazione delle numerose manifestazioni cliniche e la severità di ogni singolo sintomo presenta un’estrema variabilità da paziente a paziente. Ciò rende problematico il precoce riconoscimento della FM (Bennett RM, et al. BMC Musculoskelet Disord 2010). Sebbene si tratti di una condizione clinica nota da tempo, solo recentemente ha ricevuto una definizione scientifica ed un riconoscimento formale. I primi criteri per la classificazione della FM sono stati proposti nel 1990 dall’American College of Rheumatology (ACR) (Salaffi F, et al. Clin Exp Rheumatol. 2012) e nel 1992 l’Organizzazione Mondiale della Sanità ha riconosciuto la sindrome fibromialgica come patologia (Dichiarazione di Copenhagen), con l’inclusione nell’International Statistical Classification of Diseases and Related Health Problems (ICD) (gennaio 1993): codice “M79.0: Reumatismo non specifico”. Nella versione italiana dell’ICD-9-CM (anno 2007) la fibromialgia è classificata con il codice “729.0: Fibromialgia e reumatismi extraarticolari diffusi non specificati”. Inoltre, nel 2009 il Parlamento Europeo ha chiesto alla Commissione e al Consiglio di mettere a punto una strategia comunitaria per il suo riconoscimento come patologia, incoraggiare gli Stati membri a migliorare l’accesso alla diagnosi e ai trattamenti e promuovere la raccolta di dati. I criteri classificativi dell’ACR formulati nel 1990 (Wolfe F, et al. Arthritis Rheum 1990) richiedono la presenza di dolore muscolo-scheletrico diffuso persistende da oltre tre mesi e la positività di almeno 11 dei 18 tender points (TPs), evocabili alla digitopressione indotta da una pressione di 4 kg/cm2 o mediante algometro a pressione posizionati in sedi codificate (Figura 7). Il dolore è considerato diffuso quando tutti i seguenti punti sono presenti: dolore nella parte sinistra del corpo, dolore nel lato destro del corpo, dolore sopra la vita, e il dolore sotto la vita, dolore scheletrico assiale (colonna cervicale o toracica anteriore o della colonna vertebrale toracica o lombare). Il dolore alla spalla e al gluteo è considerato per ogni lato coinvolto. Per lombalgia è considerato il dolore segmento inferiore. Il dolore diffuso deve essere presente da almeno 3 mesi. Questi criteri consentivano di porre diagnosi di FM indipendentemente dalla presenza di altre patologie associate, con una sensibilità dell’88% e una specificità dell’81%.
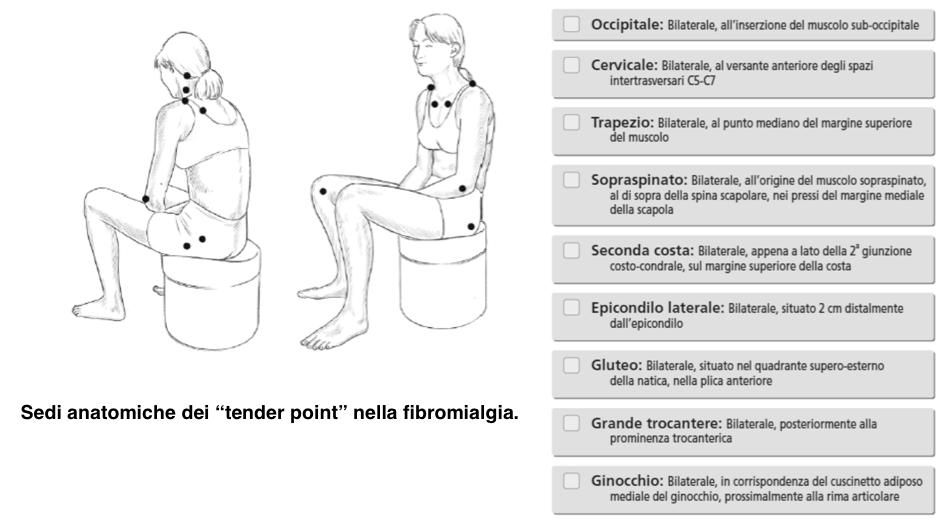
Figura 7. Sedi anatomiche dei “tender points” (Wolfe F, et al. Arthritis Rheum 1990). La digitopressione deve essere effettuata con una forza approssimativa di 4 kg/cm2. Perchè un tender point sia considerato positivo il soggetto deve provare dolore alla digitopressione. La diagnosi di FM è soddisfatta se entrambi i criteri del dolore diffuso e della presenza di almeno 11/18 TPs sono soddisfatti. La presenza di un secondo disturbo clinico non esclude la diagnosi di FM.
La valutazione del TPs, veniva spesso effettuata in maniera imprecisa o non corretta. La ricerca di questi punti inoltre richiede una certa manualità, per cui l’errata identificazione delle aree o l’applicazione di una forza eccessiva può condurre ad errori diagnostici. In alcuni casi, inoltre, i TPs sono confusi con i “punti trigger” (TrPs) caratteristici delle sindromi miofasciali localizzate. Inoltre, la soglia nocicettiva dei pazienti presenta variazioni anche in momenti diversi della stessa giornata, per cui nello stesso paziente il numero può risultare inferiore o superiore al numero richiesto per porre diagnosi a seconda del momento in cui viene esaminato. Non sempre, inoltre, i pazienti riferiscono dolore in tutti e quattro i quadranti corporei ed è presumibile che la metodica utilizzata per ricercare i TPs induca i soggetti particolarmente ansiosi a riferire precocemente una sensazione dolorosa. Inoltre, i criteri ACR 1990 non considerano altri sintomi come l’astenia, la rigidità, le alterazioni del sonno, dell’umore ed i sintomi neurologici presenti in oltre la metà dei pazienti. La constatazione che lo stesso paziente può rispettare i criteri per più sindromi differenti, ha indotto molti reumatologi a mettere in dubbio, non solo la specificità dei criteri ACR 1990, ma la stessa esistenza della FM come entità nosologica distinta (Sarzi-Puttini P, et al. Autoimmun Rev. 2018). Date le numerose perplessità sollevate da parte della comunità scientifica riguardo l’utilità di formulare la diagnosi di FM mediante la ricerca dei TPs, nel 2010, sono stati formulati dall’American College of Rheumatology (ACR), nuovi criteri classificativi (Wolfe F, et al. Arthritis Care Res (Hoboken). 2010). Pertanto, i nuovi criteri classificativi hanno proposto la combinazione delle seguenti due principali variabili (Widespread Pain Index-WPI) ed alla severità dei sintomi (Symptom Severity Score-SSS) (Wolfe F, et al. Arthritis Care Res (Hoboken). 2010). Widespread Pain Index (WPI) o indice di dolore diffuso. Comprende una checklist di 19 zone del corpo e il paziente è invitato a contare le aree specifiche in cui ha sentito dolore nella settimana precedente la compilazione del questionario, attribuendo per ciascuna un punteggio pari a 1, con un punteggio totale compreso tra 0 e 19 (cingolo scapolare sinistro, cingolo scapolare destro, braccio sinistro, braccio destro, avambraccio sinistro, avambraccio destro, anca (gluteo trocantere) sinistra, anca (gluteo trocantere) destra, coscia sinistra, coscia destra, gamba sinistra, gamba destra, mascella destra, mascella sinistra, torace, area dorsale, area lombare, collo, addome). Symptom Severity Score (SSS) o punteggio di severità dei sintomi. Il SSS ha origine dalla somma dei punteggi dei sintomi somatici, sonno non ristoratore, sintomi cognitivi, e stanchezza in una scala da 0-12. La scala SSS da sola fornisce una misura della gravità dei sintomi della FM. Per ognuno dei tre sintomi suddetti, viene indicato il grado di severità percepito dal paziente durante l’ultima settimana, mediante le seguenti scale:
- Nessun problema 1. Problemi lievi o moderati, generalmente moderati o intermittenti 2. Problemi moderati, considerevoli, spesso presenti e/o moderata intensità 3. Problemi severi, penetranti, continui, che compromettono la vita
Considerando i sintomi somatici in generale, indica se il paziente presenta:* 0. Nessun sintomo 1. Pochi sintomi 2. Un modesto numero di sintomi 3. Una gran quantità di sintomi * I sintomi somatici che devono essere presi in considerazione: dolore muscolare, sindrome del colon irritabile, fatica/affaticamento, problemi di pensiero o di ricordo, debolezza muscolare, cefalea, dolore/crampi addominali, intorbidimento/formicolio, vertigini, insonnia, depressione, stipsi, dolore nell’addome superiore, nausea, irritabilità, dolore al petto, vista annebbiata, febbre, diarrea, bocca secca, prurito, sensazione di bolo, fenomeno di Raynaud, orticaria/angiodema, tinnito, vomiti, pirosi, ulcere orali, perdita o cambiamento del gusto, attacco epilettico, occhi secchi, respiro corto, perdita dell’appetito, rash, fotosensibilità, perdita dell’udito, facile presenza di lividi, perdita di capelli, minzione frequente, minzione dolorosa e spasmi vescicali. Combinando la scala SSS ed il WPI si è giunti alla nuova definizione di FM. Per soddisfare tali criteri classificativi il paziente deve rispondere alle 3 seguenti condizioni:
- Indice per il dolore diffuso (WPI) ≥7 e il punteggio della scala per la severità dei sintomi (SS) ≥5 o WPI 3-6 e punteggio della scala per la SS ≥9
- Sintomi presenti con la stessa intensità e persistenti da almeno 3 mesi
- Assenza di condizioni cliniche concomitanti che potrebbero motivare il dolore.
I nuovi criteri standardizzano la diagnosi basata sui sintomi, affinché tutti i medici usino la stessa procedura. Questa semplice definizione di FM identifica correttamente l’88,1% dei casi classificati tramite i criteri ACR, e non richiede un esame clinico o la ricerca dei TPs. La scala di valutazione SSS consente di valutare la gravità dei sintomi. Inoltre, la definizione di “FM secondaria” non è più in uso, in quanto lo studio dell’ACR ha sottolineato l’impossibilità di distinguere, da un punto di vista diagnostico, la forma primitiva da quella secondaria. La diagnosi clinica, sebbene più semplice, resta, tuttavia, basata essenzialmente sulla valutazione soggettiva del medico sull’entità e la severità dei sintomi somatici del paziente, non permettendo un’auto-valutazione dei sintomi da parte del paziente. Per tale ragione, nel 2011, è stata proposta una modifica dei criteri ACR 2010, in cui le aree del dolore e la presenza/assenza di 3 sintomi nella SSS (cefalea, dolore o crampi addominali e sintomi depressivi) vengono auto-valutati dal paziente (Wolfe F, et al. J Rheumatol 2011). Nel 2013 è stata proposta un’ulteriore modifica che ha incrementato le aree di localizzazione del dolore, il numero di sintomi, migliorandone la specificità, indipendentemente dalla coesistenza di un’altra condizione dolorosa (Bennett RM, et al. Arthritis Care Res 2014). È importante sottolineare, tuttavia, come sia i criteri 2010, che le versioni successive del 2011 e del 2013, pur essendo di più facile e veloce esecuzione, non prevedono il riscontro di segni clinici obiettivi, elemento imprescindibile nell’iter diagnostico di una patologia così complessa come la FM. Nel 2016 è stata proposta una ulteriore revisione dei suddetti criteri da parte dell’ACR (Wolfe F, et al. Semin Arthritis Rheum. 2016), basata sulla integrazione dei criteri formulati nel 2010 (physician-based) con i criteri autosomministrati (self-report) proposti e validati nel 2011. Secondo gli Autori i criteri physician-based sono validi per la diagnosi di FM nella pratica clinica, mentre i criteri self-report sono validi per la classificazione delle persone nell’ambito della ricerca scientifica, in particolare per studi epidemiologici, presentando, tra i vantaggi, quello di ridurre il carico di lavoro del reumatologo nella raccolta delle informazioni. Secondo tale proposta (Wolfe F, et al. Semin Arthritis Rheum. 2016), per la diagnosi di FM devono essere soddisfatti contemporaneamente 3 criteri:
- dolore diffuso in specifiche aree e regioni del corpo;
- presenza di sintomi caratteristici (astenia, sonno non ristoratore, problemi cognitivi, emicrania, dolore/crampi addominali, depressione) che compromettono la vita quotidiana;
- durata della sintomatologia pari ad almeno 3 mesi
La severità della sintomatologia viene, solitamente, misurata attraverso un indice, denominato Fibromyalgia Severity Scale (noto anche come, Polysymptomatic Distress Scale), il cui punteggio è rappresentato dalla somma dei punteggi conseguiti da 2 sotto-indici:
- indice di diffusione del dolore (Widespread Pain Index -WPI)
- indice di gravità dei sintomi (Symptom Severity Scale-SSS).
Il punteggio finale dell’indice di diffusione del dolore (o WPI) corrisponde alla somma delle aree dolorose presenti (comprese da 0 a 19) (Figura 8). Il punteggio finale dell’indice di gravità dei sintomi corrisponde alla somma dei livelli di gravità di 3 sintomi (astenia, sonno non ristoratore, problemi cognitivi), misurati con una scala ordinale a 4 livelli (Figura 6):
- da 0 (nessun problema nella vita quotidiana) a 3 (gravi problemi nella vita quotidiana),
- alla presenza/assenza di altri 3 sintomi (emicrania, dolore / crampi addominali, depressione), misurati ognuno con una scala dicotomica compresa tra 0 (sintomo assente) e 1 (sintomo presente).
Il punteggio massimo ottenibile dalla scala di gravità dei sintomi è pertanto pari a 12. Sono stati attribuiti dei valori cut-off sia all’indice complessivo, Fibromyalgia Severity Scale, che ai 2 sotto-indici specifici, al di sopra dei quali è possibile attestare la diagnosi di FM o il soddisfacimento di un determinato criterio. In particolare, una persona può essere diagnostica come affetta da FM in presenza di un punteggio >=12 della Fibromyalgia Severity Scale o Polysymptomatic Distress (PSD) scale, che corrisponde alla somma dei punteggi:
- > = 7 dell’indice di diffusione del dolore (WPI) e >=5 dell’indice di gravità dei sintomi (SSS);
- oppure 4-6 dell’indice di diffusione del dolore (WPI) e > =9 dell’indice di gravità dei sintomi (SSS).
La diagnosi di FM deve essere ritenuta valida, indipendentemente da altre diagnosi o malattie concomitanti e, comunque, non esclude la presenza di altri disturbi clinicamente rilevanti. I punteggi calcolati mediante la scala PSD possono, inoltre, essere impiegati per categorizzare i differenti livelli di severità di malattia: normale (0–3), lieve (4–7), moderata (8–11), severa (12–19), e molto severa (20–31) (Wolfe F, et al. J Rheumatol. 2015 – Häuser W, et al. Arthritis Care Res (Hoboken). 2017).
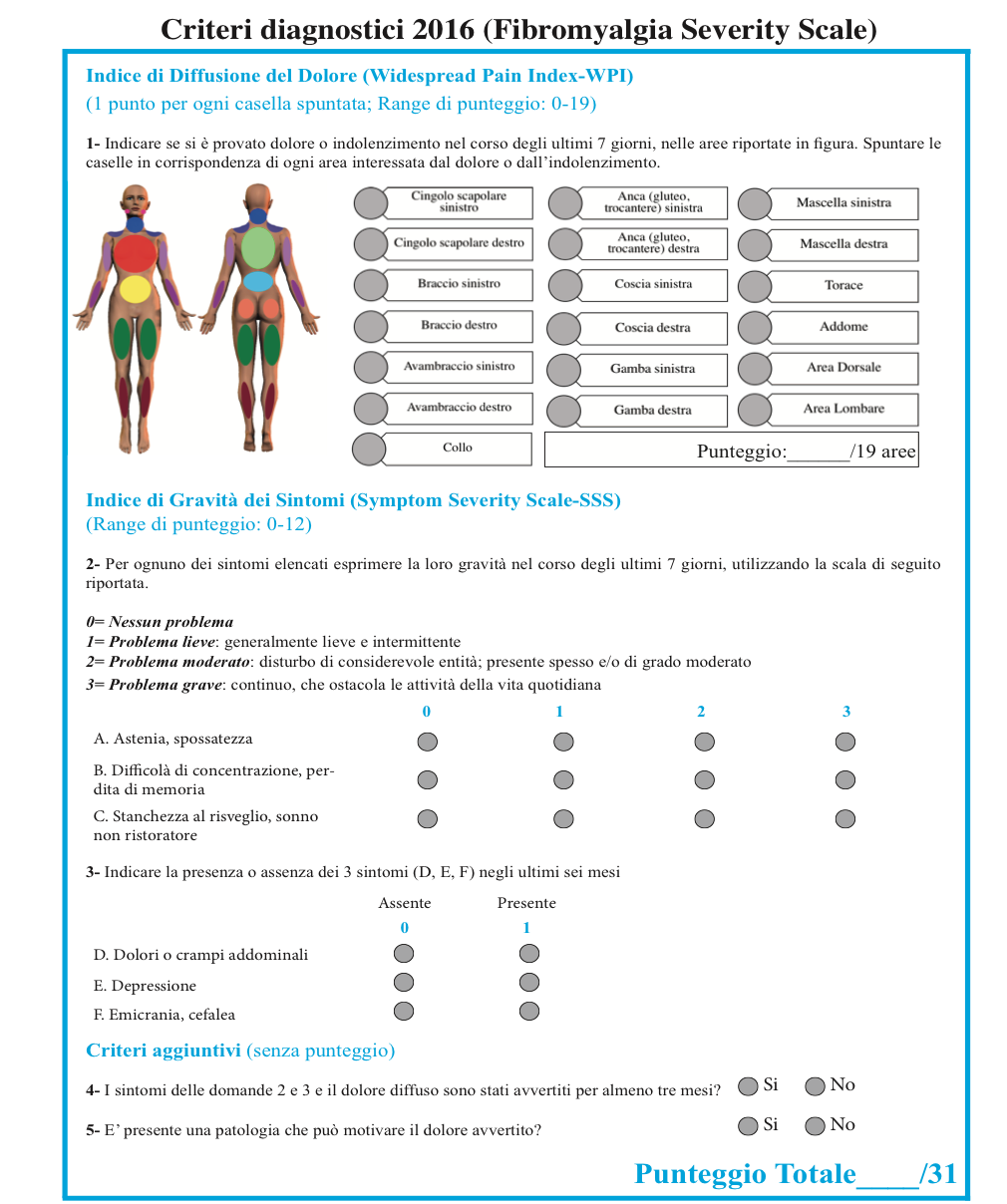
Figura 8. Criteri diagnostici proposti dall’American College of Rheumatology (ACR) del 2016 per la diagnosi di FM
Recentemente, nel 2018, grazie alla partnership tra l’ACTTION (Analgesic, Anesthetic, and Addiction Clinical Trial Translations Innovations Opportunities and Networks) con la Food and Drug Administration (FDA) statunitense e l’American Pain Society (APS) è stata avviata la ACTTION-APS Pain Taxonomy (AAPT) con l’intento di sviluppare criteri diagnostici semplificati per la FM. Tali criteri, come per i precedenti, sono esclusivamente basati sui sintomi clinici, non prevedono il conteggio dei TPs e richiedono la persistenza del dolore cronico (per almeno 3 mesi) in 6 o più aree corporee, delle 9 sedi individuate, in associazione alla coesistenza di moderati o severi disturbi del sonno o della fatica (Figura 9). I criteri AAPT sono, al momento, ritenuti scarsamente performanti, rispetto ai criteri formulati nel 2016 e sono associati ad un elevato tasso di “falsi positivi” (Wolfe F. J Pain. 2019).
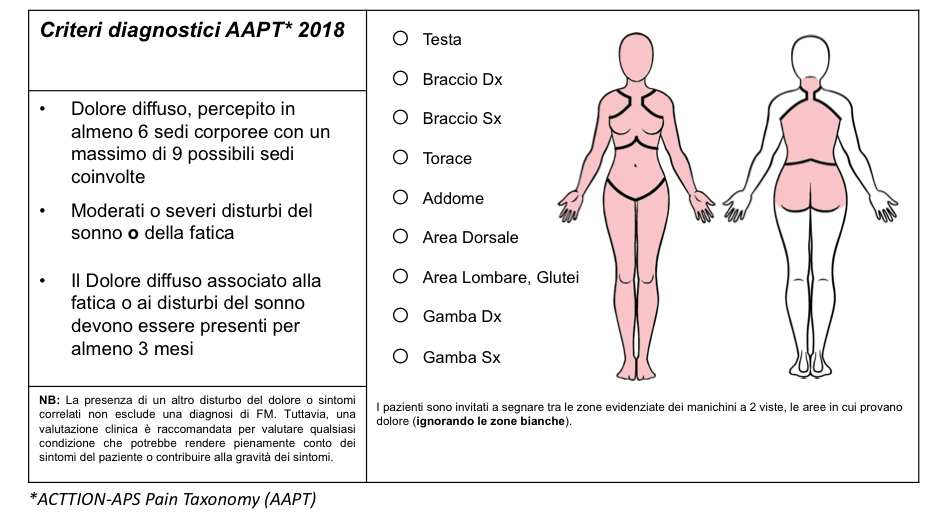
Figura 9. Criteri diagnostici semplificati proposti dall’ACTTION-APS Pain Taxonomy (AAPT) per la diagnosi di fibromialgia
Punti chiave
- La fibromialgia (FM) è definita come “una sindrome da sensibilizzazione centrale caratterizzata dalla disfunzione dei neurocircuiti preposti alla percezione, trasmissione e processazione delle afferenze nocicettive, con prevalente estrinsecazione del dolore a livello dell’apparato muscoloscheletrico”.
- La FM è caratterizzata da dolore muscoloscheletrico cronico e diffuso, spesso associata ad astenia, disturbi del sonno, problemi cognitivi (es. di attenzione, di memoria), problemi psichici (es. ansia, depressione) e ad un ampio insieme di sintomi somatici e neurovegetativi. La FM occupa, per frequenza, il 2°-3° posto tra le malattie reumatiche e rappresenta il 12-20% delle diagnosi formulate in ambito ambulatoriale.
- La diagnosi di FM, codificata da criteri internazionali, resta basata essenzialmente sulla valutazione soggettiva del medico circa l’entità e la severità dei sintomi somatici e neuroviscerali del paziente. Non sono raccomandate indagini strumentali.
Bibliografia
- Talotta R, Atzeni F, Bazzichi L, Giacomelli C, Di Franco M, Salaffi F, Sarzi-Puttini P. Algo-dysfunctional syndromes: a critical digest of the recent literature. Clin Exp Rheumatol.2015;33(1 Suppl 88):S102-8.
- Salaffi F, De Angelis R, Grassi W; MArche Pain Prevalence; INvestigation Group (MAPPING) study. Prevalence of musculoskeletal conditions in an Italian population sample: results of a regional community-based study. I. The MAPPING study. Clin Exp Rheumatol. 2005;23(6):819-28.
- Ferraccioli G, Cavalieri F, Salaffi F, Fontana S, Scita F, Nolli M, Maestri D. Neuroendocrinologic findings in primary fibromyalgia (soft tissue chronic pain syndrome) and in other chronic rheumatic conditions (rheumatoid arthritis, low back pain). J Rheumatol. 1990;17(7):869-73.
- Ferraccioli G, Guerra P, Rizzi V, Baraldo M, Salaffi F, Furlanut M, Bartoli E. Somatomedin C (insulin-like growth factor 1) levels decrease during acute changes of stress related hormones. Relevance for fibromyalgia. J Rheumatol. 1994;21(7):1332-4.
- Lawson K. Treatment options and patient perspectives in the management of fibromyalgia: future trends. Neuropsychiatr Dis Treat. 2008;4(6):1059-71.
- Kadetoff D, Lampa J, Westman M, Andersson M, Kosek E. Evidence of central inflammation in fibromyalgia-increased cerebrospinal fluid interleukin-8 levels. J Neuroimmunol. 2012;242(1-2):33-8.
- Watkins LR, Hutchinson MR, Rice KC, Maier SF. The “toll” of opioid-induced glial activation: improving the clinical efficacy of opioids by targeting glia. Trends Pharmacol Sci. 2009;30(11):581-91.
- Harris RE, Sundgren PC, Craig AD, Kirshenbaum E, Sen A, Napadow V, et al. Elevated insular glutamate in fibromyalgia is associated with experimental pain. Arthritis Rheum. 2009;60(10):3146-52.
- Foerster BR, Petrou M, Edden RA, Sundgren PC, Schmidt-Wilcke T, Lowe SE, et al. Reduced insular gamma-aminobutyric acid in fibromyalgia. Arthritis Rheum. 2012;64(2):579-83.
- Petrovic P, Kalso E, Petersson KM, Ingvar M. Placebo and opioid analgesia– imaging a shared neuronal network. Science. 2002;295(5560):1737-40.
- Littlejohn G. Neurogenic neuroinflammation in fibromyalgia and complex regional pain syndrome. Nat Rev Rheumatol. 2015;11(11):639-48.
- Guedj E, Taieb D, Cammilleri S, Lussato D, de Laforte C, Niboyet J, et al. 99mTc-ECD brain perfusion SPECT in hyperalgesic fibromyalgia. Eur J Nucl Med Mol Imaging. 2007;34(1):130-4.
- Gracely RH, Petzke F, Wolf JM, Clauw DJ. Functional magnetic resonance imaging evidence of augmented pain processing in fibromyalgia. Arthritis Rheum. 2002;46(5):1333-43.
- Feraco P, Bacci A, Pedrabissi F, Passamonti L, Zampogna G, Pedrabissi F, Malavolta N, Leonardi M. Metabolic abnormalities in pain-processing regions of patients with fibromyalgia: a 3T MR spectroscopy study. AJNR Am J Neuroradiol. 2011;32(9):1585-90.
- Uceyler N, Zeller D, Kahn AK, Kewenig S, Kittel-Schneider S, Schmid A, et al. Small fibre pathology in patients with fibromyalgia syndrome. Brain. 2013;136(Pt 6):1857-67.
- De Tommaso M, Nolano M, Iannone F, Vecchio E, Ricci K, Lorenzo M, Delussi M, Girolamo F, Lavolpe V, Provitera V, Stancanelli A, Lapadula G, Livrea P. Update on laser-evoked potential findings in fibromyalgia patients in light of clinical and skin biopsy features. J Neurol. 2014;261(3):461-72. doi: 10.1007/s00415-013-7211-9.
- Buskila D, Sarzi-Puttini P, Ablin JN. The genetics of fibromyalgia syndrome. Pharmacogenomics. 8:67-74, 2007.
- Kosek E, Martinsen S, Gerdle B, Mannerkorpi K, Lofgren M, Bileviciute- Ljungar I, Fransson P, Schalling M, Ingvar M, Ernberg M, Jensen KB. The translocator protein gene is associated with symptom severity and cerebral pain processing in fibromyalgia. Brain Behav Immun 58:218-227, 2016.
- Stisi S, Cazzola M, Buskila D, Spath M, Giamberardino MA, Sarzi-Puttini P, Arioli G, Alciati A, Leardini G, Gorla R, Marsico A, Ceccherelli F, Bazzichi L, Carignola R, Gracely RH, Salaffi F, Marinangeli F, Torta R, Di Franco M, Biasi G, Cassisi G, Casale R, Altomonte L, Atzeni F; Italian Fibromyalgia Network. Etiopathogenetic mechanisms of fibromyalgia syndrome. Reumatismo. 2008;60 Suppl 1:25-35.
- Salaffi F, Atzeni F, Talotta R, Di Carlo M, Sarzi-Puttini P. Earthquake vulnerability of fibromyalgia patients: sixmonth follow-up after the catastrophic disasters in central Italy. Clin Exp Rheumatol. 2017;35 Suppl 105(3):93-99.
- Ercolani M, Trombini G, Chattat R, Cervini C, Piergiacomi G, Salaffi F, Zeni S, Marcolongo R. Fibromyalgic syndrome: depression and abnormal illness behavior. Multicenter investigation. Psychother Psychosom. 1994;61(3-4):178-86.
- Atzeni F, Cazzola M, Benucci M, Di Franco M, Salaffi F, Sarzi-Puttini P. Chronic widespread pain in the spectrum of rheumatological diseases. Best Pract Res Clin Rheumatol. 2011;25(2):165-71.
- Häuser W, Sarzi-Puttini P, Fitzcharles MA. Fibromyalgia syndrome: under-over- and misdiagnosis. Clin Exp Rheumatol. 2019;37 Suppl 116(1):90-97.
- Di Franco M, Iannuccelli C, Bazzichi L, Atzeni F, Consensi A, Salaffi F, Pietropaolo M, Alessandri C, Basili S, Olivieri M, Bombardieri S, Valesini G, Sarzi-Puttini P. Misdiagnosis in fibromyalgia: a multicentre study. Clin Exp Rheumatol. 2011;29(6 Suppl 69):S104-8.
- Doria A, Rinaldi S, Salaffi F, et al. Health-related quality of life in Italian patients with systemic lupus erythematosus. II. Role of clinical, immunological and psychological determinants. Rheumatology (Oxford). 2004;43(12):1580-6.
- Rinaldi S, Doria A, Salaffi F, et al. Health related quality of life in Italian patients with systemic lupus erythematosus. I. Relationship between physical and mental dimension and impact of age. Rheumatology (Oxford). 2004;43(12):1574-9.
- Staud R. Are patients with systemic lupus erythematosus at increased risk for fibromyalgia? Curr Rheumatol Rep 2006; 8: 430-5.
- Giles I, Isenberg D. Fatigue in primary Sjogren’s syndrome: is there a link with the fibromyalgia syndrome? Ann Rheum Dis 2000; 59: 875-8.
- De Angelis R, Salaffi F, Grassi W. Prevalence of spondyloarthropathies in an Italian population sample: a regional community-based study. Scand J Rheumatol. 2007;36(1):14-21.
- Salaffi F, De Angelis R, Carotti M, Gutierrez M, Sarzi-Puttini P, Atzeni F. Fibromyalgia in patients with axial spondyloarthritis: epidemiological profile and effect on measures of disease activity. Rheumatol Int. 2014;34(8):1103-10.
- Salaffi F, Di Carlo M, Carotti M, Sarzi-Puttini P. The effect of neuropathic pain symptoms on remission in patients with early rheumatoid arthritis. Curr Rheumatol Rev. 2018 Aug 6. doi: 10.2174/1573397114666180806142814.
- Sarzi-Puttini P, Salaffi F, Di Franco M, Bazzichi L, Cassisi G, Casale R, Cazzola M, Stisi S, Battellino M, Atzeni F. Pain in rheumatoid arthritis: a critical review. Reumatismo. 2014,6;66(1):18-27.
- Salaffi F, Sarzi-Puttini P, Girolimetti R, Atzeni F, Gasparini S, Grassi W. Health-related quality of life in fibromyalgia patients: a comparison with rheumatoid arthritis patients and the general population using the SF-36 health survey. Clin Exp Rheumatol. 2009;27(5 Suppl 56):S67-74.
- Salaffi F, Gerardi MC, Atzeni F, Batticciotto A, Talotta R, Draghessi A, Di Carlo M, Sarzi-Puttini P. The influence of fibromyalgia on achieving remission in patients with long-standing rheumatoid arthritis. Rheumatol Int. 2017;37(12):2035-2042.
- Salaffi F, Ciapetti A, Sarzi Puttini P, Atzeni F, Iannuccelli C, Di Franco M, Cazzola M, Bazzichi L. Preliminary identification of key clinical domains for outcome evaluation in fibromyalgia using the Delphi method: the Italian experience. Reumatismo. 2012;64(1):27-34.
- Salaffi F, Mozzani F, Draghessi A, Atzeni F, Catellani R, Ciapetti A, Di Carlo M, Sarzi-Puttini P. Identifying the symptom and functional domains in patients with fibromyalgia: results of a cross-sectional Internet-based survey in Italy. J Pain Res. 2016;9:279-86.
- Cazzola M, Sarzi Puttini P, Stisi S, Di Franco M, Bazzichi L, Carignola R, Gracely RH, Salaffi F, Marinangeli F, Torta R, Giamberardino MA, Buskila D, Spath M, Biasi G, Cassisi G, Casale R, Altomonte L, Arioli G, Alciati A, Marsico A, Ceccherelli F, Leardini G, Gorla R, Atzeni F; Italian Fibromyalgia Network. Fibromyalgia syndrome: definition and diagnostic aspects. Reumatismo. 2008;60 Suppl 1:3-14.
- Salaffi F, Stancati A, Procaccini R, Cioni F, Grassi W. Assessment of circadian rhythm in pain and stiffness in rheumatic diseases according the EMA (Ecologic Momentary Assessment) method: patient compliance with an electronic diary. Reumatismo. 2005;57(4):238-49.
- Sarzi-Puttini P, Atzeni F, Salaffi F. Pain in rheumatic diseases: how relevant is it? Reumatismo. 2014;66(1):1-3.
- Salaffi F, Giacobazzi G, Di Carlo M. Chronic Pain in Inflammatory Arthritis: Mechanisms, Metrology, and Emerging Targets-A Focus on the JAK-STAT Pathway. Pain Res Manag. 2018,7;2018:8564215.
- Torta RG, Tesio V, Ieraci V, Castelli L, Zizzi FB. Fibro-fog. Clin Exp Rheumatol. 2016;34(2 Suppl 96):S6-8.42. Cassisi G, Sarzi-Puttini P, Alciati A, Casale R, Bazzichi L, Carignola R, Gracely RH, Salaffi F, Marinangeli F, Torta R, Giamberardino MA, Buskila D, Spath M, Cazzola M, Di Franco M, Biasi G, Stisi S, Altomonte L, Arioli G, Leardini G, Gorla R, Marsico A, Ceccherelli F, Atzeni F; Italian Fibromyalgia Network. Symptoms and signs in fibromyalgia syndrome. Reumatismo. 2008;60 Suppl 1:15-24.
- Lee J, Protsenko E, Lazaridou A, Franceschelli O, Ellingsen DM, Mawla I, Isenburg K, Berry MP, Galenkamp L, Loggia ML, Wasan AD, Edwards RR, Napadow V. Encoding of Self-Referential Pain Catastrophizing in the Posterior Cingulate Cortex in Fibromyalgia. Arthritis Rheumatol. 2018;70(8):1308-1318.
- Choy EH. The role of sleep in pain and fibromyalgia. Nat Rev Rheumatol. 2015;11(9):513-20.
- Ablin JN, Clauw DJ, Lyden AK Ambrose K, Williams DA, Gracely RH, Glass JM. Effects of sleep restriction and exercise deprivation on somatic symptoms and mood in healthy adults. Clin Exp Rheumatol. 2013;31(6 Suppl 79):S53-9.
- Bennett RM, Russell J, Cappelleri JC, Bushmakin AG, Zlateva G, Sadosky A. Identification of symptom and functional domains that fibromyalgia patients would like to see improved: a cluster analysis. BMC Musculoskelet Disord 2010;11:134.
- Salaffi F, Sarzi-Puttini P. Old and new criteria for the classification and diagnosis of fibromyalgia: comparison and evaluation. Clin Exp Rheumatol. 2012;30(6 Suppl 74):3-9.
- Wolfe F, Smythe HA, Yunus MB, et al. The American College of Rheumatology (ACR) 1990 criteria for classification of fibromyalgia. Arthritis Rheum 1990;33:160-72.
- 49. Sarzi-Puttini P, Atzeni F, Masala IF, Salaffi F, Chapman J, Choy E. Are the ACR 2010 diagnostic criteria for fibromyalgia better than the 1990 criteria? Autoimmun Rev. 2018;17(1):33-35.
- 50. Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Katz RS, Mease P, Russell AS, Russell IJ, Winfield JB, Yunus MB. The American College of Rheumatology preliminary diagnostic criteria for fibromyalgia and measurement of symptom severity. Arthritis Care Res (Hoboken). 2010;62(5):600-10.
- Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Hauser W, Katz RS, et al. Fibromyalgia criteria and severity scales for clinical and epidemiological studies: a modification of the ACR preliminary diagnostic criteria for fibromyalgia. J Rheumatol 2011;38:1113–22.
- Bennett RM, Friend R, Marcus D, Bernstein C, Han BK, Yachoui R et al. Criteria for the diagnosis of fibromyalgia: validation of the modified 2010 preliminary American College of Rheumatology criteria and the development of alternative criteria. Arthritis Care Res 2014; 66(9):1364-73.
- Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Häuser W, Katz RL, Mease PJ, Russell AS, Russell IJ, Walitt B. 2016 Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Semin Arthritis Rheum. 2016;46(3):319-329.54.
- Wolfe F, Walitt BT, Rasker JJ, Katz RS, Häuser W. The Use of Polysymptomatic Distress Categories in the Evaluation of Fibromyalgia (FM) and FM Severity. J Rheumatol. 2015;42(8):1494-501.
- Häuser W, Clauw DJ, Fitzcharles MA. Treat-to-Target Strategy for Fibromyalgia: Opening the Dialogue. Arthritis Care Res (Hoboken). 2017;69(4):462-466.
- Arnold LM, Bennett RM, Crofford LJ, Dean LE, Clauw DJ, Goldenberg DL, Fitzcharles MA, Paiva ES, Staud R, Sarzi-Puttini P, Buskila D, Macfarlane GJ. AAPT Diagnostic Criteria for Fibromyalgia. J Pain. 2018 Nov 16. pii:S1526-5900(18)30832-0.
- Wolfe F. Letter to the editor, “Fibromyalgia Criteria”. J Pain. 2019 Feb 11. pii: S1526-5900(18)30920-9. doi: 10.1016/j. jpain.2019.02.002.
