LA GESTIONE DELLA SPONDILITE ANCHILOSANTE E DEL DOLORE ASSOCIATO ALLA MALATTIA: ANALISI DEI COSTI IN ITALIA
AUTORI:
Giovanna Elisa Calabrò1,2, Michele Basile3, Florenzo Iannone4, Salvatore D’Angelo5, Roberto Ricciardi2, Americo Cicchetti3, Fausto Salaffi6
1Sezione di Igiene, Dipartimento Universitario di Scienze della Vita e Sanità Pubblica, Università Cattolica del Sacro Cuore, Roma; 2VIHTALI (Value In Health Technology and Academy for Leadership & Innovation), Spin-off dell’Università Cattolica del Sacro Cuore, Roma; 3Alta Scuola di Economia e Management dei Sistemi Sanitari (ALTEMS), Università Cattolica del Sacro Cuore, Roma; 4U.O.C. di Reumatologia, Università degli Studi Aldo Moro di Bari; 5U.O.C. di Reumatologia, Azienda Ospedaliera “San Carlo” di Potenza; 6Clinica Reumatologica-Dipartimento di Scienze Cliniche e Molecolari – Università Politecnica delle Marche
Introduzione
Con il termine “artrite” si intende una condizione infiammatoria cronica che può coinvolgere una o più articolazioni, sia le grandi che le piccole articolazioni, frequentemente accompagnata da tumefazione, arrossamento, dolore, aumento della rigidità articolare e conseguente perdita di capacità funzionale. Le forme più gravi di artrite possono deformare le articolazioni, compromettendo la possibilità di svolgere anche i più semplici compiti quotidiani. Esistono un centinaio di forme di artrite che rientrano tutte nella categoria più ampia di malattie reumatiche, ciascuna con cause e caratteristiche specifiche. Occupano il primo posto tra le patologie croniche che causano disabilità, soprattutto tra gli anziani, nonostante possano colpire precocemente anche attorno ai 30 anni d’età. Nell’Unione Europea, i rapporti sulla salute indicano che le malattie muscoloscheletriche, delle quali le artriti sono una parte preminente, interessano il 50% della popolazione, soprattutto di genere femminile. In Italia, secondo quanto riportato dall’Istituto Superiore di Sanità (ISS), le persone che dichiarano di soffrire di una malattia cronica sono circa il 47% (50,9% delle donne e 43% degli uomini). Tra queste, le artriti sono le malattie più frequentemente dichiarate (oltre il 18 %, con un 22,8% tra le donne e 13,6% tra gli uomini).
Le diverse forme di artrite costituiscono, dunque, un enorme problema di salute pubblica a causa dell’elevata prevalenza nella popolazione generale nonché per i costi terapeutici e previdenziali derivanti dall’inabilità di chi ne è colpito, sia in termini lavorativi sia di svolgimento delle mansioni quotidiane.
Tra le diverse forme di artrite rientrano le spondiloartriti. Il termine di spondiloartriti o SpA è stato introdotto per definire un gruppo di malattie reumatiche infiammatorie ad andamento cronico, classificate tra le affezioni su base immunitaria (Immune-Mediated Inflammatory Disease). Attualmente, le SpA vengono suddivise in sette sottotipi principali: la spondilite anchilosante (SA), l’artrite psoriasica (AP), le spondiloartriti reattive, le spondiloartriti enteropatiche (associate a malattie infiammatorie croniche intestinali, quali la colite ulcerosa e la malattia di Crohn), le spondiloartriti indifferenziate, le spondiloartriti dell’infanzia o giovanili e l’uveite anteriore acuta – HLA-B27 positiva. Le più comuni sono la SA e l’AP. L’avvento delle nuove metodiche di imaging, in particolare della Risonanza magnetica (RM) e la disponibilità di nuovi e più efficaci trattamenti farmacologici hanno rinnovato l’interesse verso la classificazione delle SpA. Il concetto di “spondiloartrite assiale” comprende i vari stadi della malattia, da quello più precoce, in cui non vi è evidenza di danno radiografico e il coinvolgimento sacro-iliaco può essere evidenziato solo con la RM (stadio “non-radiografico”) a quello più tardivo in cui sono evidenti il danno osseo secondario a sacro-ileite e l’anchilosi della colonna. La diagnosi di SpA assiale in stadio “non-radiografico” può essere effettuata combinando parametri clinici, di laboratorio e tecniche di imaging, in particolare la RM, che consente di evidenziare la flogosi delle articolazioni sacroiliache all’esordio della malattia.
I sintomi della malattia artritica si manifestano su diversi piani: fisico, psicologico e sociale. Dal punto di vista fisico, coloro che ne sono affetti possono lamentare una serie di sintomi, quali dolori articolari, stanchezza, spossatezza e perdita della funzionalità motoria. La lombalgia infiammatoria rappresenta il sintomo cardine del quadro clinico delle spondiloartriti assiali. Il suo riconoscimento riveste un ruolo cruciale nella diagnosi di malattia. La definizione di lombalgia infiammatoria comprende alcune caratteristiche del dolore quali: l’esordio insidioso, la presenza di dolore a riposo tale da svegliare il paziente di notte o nelle prime ore del mattino, la presenza di rigidità articolare al mattino, il miglioramento della sintomatologia con il movimento e non con il riposo, la presenza di glutealgia alternante. Tali elementi sono fondamentali nel differenziare una lombalgia infiammatoria da una sintomatologia di tipo meccanico, il che non risulta sempre agevole soprattutto per i medici di medicina generale (MMG) o di altre branche specialistiche. La ridotta mobilità conseguente, inoltre, comporta un elevato rischio di incorrere in patologie cardiovascolari, diabete, ipertensione, sovrappeso e obesità. Dal punto di vista psicologico, invece, i pazienti possono lamentare stress, depressione, rabbia, ansia, senso di impotenza e mancanza di autocontrollo. Le problematiche finora descritte si riflettono a livello sociale con tendenza all’isolamento, difficoltà nel lavoro e a scuola, e problemi sessuali.
L’attuale modello di gestione della spondiloartrite presenta alcune criticità. I professionisti sanitari in setting non specialistici spesso non riconoscono segni e sintomi delle spondiloartriti. Le presentazioni assiali spesso vengono diagnosticate erroneamente come lombalgie di tipo meccanico, con conseguente ritardo nel trattamento. Tra insorgenza dei sintomi e diagnosi intercorre un ritardo medio di 8,5 anni: solo il 15% circa dei casi riceve una diagnosi entro 3 mesi dalla presentazione iniziale. Inoltre, le spondiloartriti assiali non sono sempre evidenti alla radiografia standard e spesso si manifestano in pazienti HLAB27 positivi ma possono presentarsi anche in pazienti HLAB27 negativi: ne deriva che il test presenti una bassa specificità se applicato alla popolazione generale (solo il 2% circa dei pazienti positivi svilupperà una SA) e che non possa essere inteso come test di screening da applicare su ampia scala ai pazienti con lombalgia. In assenza di altri tests di laboratorio di significato diagnostico, una elevazione degli indici di flogosi può essere un dato indicativo (presente nel 50-70% dei pazienti con spondiloartriti) ma non sempre correla con l’attività di malattia. Le manifestazioni periferiche vengono spesso interpretate come problemi articolari o tendinei non collegati tra loro, generando diagnosi errate perché possono migrare tra diverse articolazioni. Anche in persone con comorbidità note (es. psoriasi), le spondiloartriti periferiche possono non essere riconosciute.
Un ruolo fondamentale nella valutazione diagnostica di un paziente con spondiloartrite è rappresentato dallo studio di imaging. L’esame radiografico standard permette, come già detto, di evidenziare alterazioni, tardive, a carico delle articolazioni sacro-iliache (slargamento della rima articolare, erosioni, sclerosi, fusione) e del rachide (sindesmofiti, squadramento o erosioni dei corpi vertebrali), mentre la RM rileva anche in fase molto precoce la presenza di attività infiammatoria (edema osseo nelle sequenze STIR) a livello delle sedi (rachide e/o articolazioni sacroiliache) coinvolte. Altri esami strumentali quali la Tomografia Computerizzata (TC) e la Scintigrafia ossea non trovano, invece, indicazioni specifiche nel percorso diagnostico di una lombalgia infiammatoria
Per quanto riguarda il trattamento delle spondiloartriti, ad oggi le principali linee guida internazionali e nazionali propongono diverse opzioni terapeutiche, farmacologiche e non, in grado di alleviare i principali sintomi della malattia, tuttavia, persiste un problema importante che si correla ad una appropriata gestione del dolore cronico, sintomo dominante nel quadro clinico dei pazienti affetti da queste patologie. Pertanto, risulta fondamentale identificare i pazienti con dolore, non solo per una diagnosi accurata, ma soprattutto per un trattamento ottimale e precoce della malattia infiammatoria.
La Spondilite Anchilosante
La spondilite anchilosante (SA) è una malattia infiammatoria cronica che colpisce elettivamente lo scheletro assiale (colonna vertebrale e articolazioni sacroiliache), ma può interessare anche lo scheletro appendicolare e le entesi. La prevalenza della SA presenta un’ampia variabilità a seconda dell’etnia e dei criteri diagnostici adottati. In Italia è stimata nell’ordine dello 0,37%. La SA esordisce in giovani adulti (seconda o terza decade di vita) e colpisce prevalentemente il sesso maschile. Il quadro clinico è dominato dalla lombalgia di tipo infiammatorio, caratterizzata da dolore localizzato alla regione sacrale e ai glutei, con possibile proiezione alla faccia posteriore della coscia e al cavo popliteo (sciatica mozza), ad andamento alternato (basculante) ed associata a rigidità al risveglio. Tale sintomatologia manifesta un andamento a poussée, con periodi della durata di qualche giorno e successiva remissione spontanea (tali episodi si ripetono con maggior frequenza, sino ad assumere carattere di continuità) e può insorgere anche in altri segmenti del rachide, specie del tratto cervicale. Con l’evoluzione della malattia, in genere lenta, peggiora la rigidità del rachide, che si accompagna ad una progressiva perdita della lordosi lombare e alla comparsa di una cifosi dorsale determinando, nelle forme più evolute, la caratteristica andatura “dell’uomo curvo”, caratterizzata da un atteggiamento in semiflessione delle anche e delle ginocchia ed una incapacità alla flessione del rachide. In caso di interessamento del rachide cervicale, il paziente ha il capo reclinato in avanti e presenta una marcata limitazione dei movimenti del collo. L’anchilosi ossea che coinvolge, oltre alle vertebre dorsali, le articolazioni costo-vertebrali, costo-trasversarie, sternoclavicolari e manubrio-sternale, può determinare una riduzione della espansibilità della gabbia toracica che, nelle fasi avanzate, compromette la capacità ventilatoria, con respiro di tipo addominale dovuto esclusivamente ai movimenti del diaframma. Non raramente l’esordio della SA può essere atipico per il prevalente interessamento delle articolazioni periferiche, sia di tipo rizomelico (spalle o coxo-femorali), che mono- od oligo-articolare (artrite del ginocchio, della tibio-tarsica). Possono essere presenti un coinvolgimento delle entesi (tendine di Achille, fascia plantare, tuberosità ischiatica) e, talvolta, anche manifestazioni extra-articolari (uveite acuta anteriore monolaterale). Il quadro clinico della SA può includere, infine, il coinvolgimento degli apparati respiratorio (malattia fibro-bollosa dell’apice polmonare, malattia interstiziale diffusa), cardiovascolare (aortite associata ad insufficienza aortica, alterazioni della conduzione atrio-ventricolare) e complicanze neurologiche (sublussazione atlo-epistrofica con conseguente impegno midollare cervicale, sindrome della cauda equina) o renali (glomerulonefrite da depositi di IgA, amiloidosi). Frequente è l’interessamento subclinico dell’intestino con lesioni endoscopiche ed istologiche prevalentemente localizzate a livello dell’ileo terminale e della valvola ileocecale.
Nel corso degli anni è stata proposta una serie di criteri classificativi per la SA come entità clinica a sé stante. Attualmente, quelli più utilizzati sono i criteri di New York (NY) modificati che prevedono la presenza di segni di sacroileite in radiologia convenzionale (almeno di grado 2 se bilaterale, o di grado 3-4 se monolaterale) in associazione ad almeno un elemento tra: rachialgia infiammatoria cronica, limitazione della mobilità della colonna lombare, limitazione dell’espansione della gabbia toracica.
Questi criteri, che prevedono inderogabilmente l’evidenza radiologica di sacroileite, comportano tuttavia un ritardo diagnostico, con un tempo medio tra l’esordio dei sintomi e la diagnosi compreso fra i 5 ed i 7 anni. Data la potenziale limitazione dei criteri di NY modificati nel categorizzare l’intero spettro clinico delle SpA, negli anni ‘90 sono stati formulati i criteri di Amor e quelli del Gruppo di Studio Europeo delle Spondiloartropatie (ESSG). Successivamente, nel 2009, da parte del gruppo ASAS (Assessment of SpondyloArthritis International Society) (http://asas-group.org/mission-statement.php) è stato introdotto un utile algoritmo diagnostico che prevede il precoce riconoscimento del dolore infiammatorio del rachide e la presenza dei segni clinici peculiari di tale gruppo di affezioni (storia familiare, entesiti, uveite, glutealgia basculante, artrite periferica, dattilite, psoriasi, malattie infiammatorie intestinali, risposta al trattamento con antinfiammatori non-steroidei, incremento degli indici di flogosi) o, in alternativa, la positività dell’antigene HLA-B27 e il riscontro dei tipici reperti di infiammazione attiva a carico delle articolazioni sacroiliache alla RM o di sacroileite alla radiologia convenzionale (Figura 1).
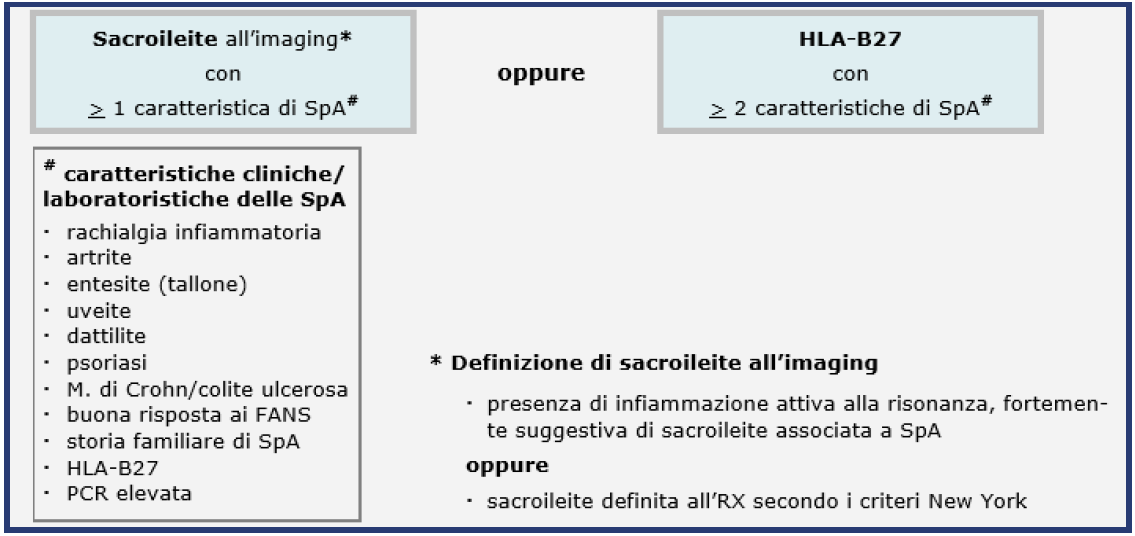 Figura 1. Criteri ASAS per la diagnosi di Spondiloartrite assiale (Rudwaleit M, 2009) applicabili a pazienti con dolore lombare da 3 o più mesi e comparso prima dei 45 anni di età.
Figura 1. Criteri ASAS per la diagnosi di Spondiloartrite assiale (Rudwaleit M, 2009) applicabili a pazienti con dolore lombare da 3 o più mesi e comparso prima dei 45 anni di età.
La RM consente la visualizzazione dell’edema osseo intraspongioso, del versamento articolare, dell’entesite, della capsulite e della sinovite. Tuttavia, con l’utilizzo di sequenze appropriate, tale tecnica di imaging permette anche l’evidenziazione delle lesioni tipiche della fase radiologica e tardiva, quali le erosioni, la sclerosi subcondrale, la neoproduzione ossea, fino all’anchilosi, e gioca, pertanto, un ruolo fondamentale anche nella identificazione e quantificazione del danno strutturale e nella valutazione della sua progressione nel tempo. In corso di SpA, come per le articolazioni sacroiliache, anche per la valutazione dell’impegno del rachide, la RM gioca un ruolo fondamentale nella fase non-radiologica. Essa rappresenta, infatti, l’unica tecnica di imaging in grado di visualizzare l’edema osseo intraspongioso/osteite, la flogosi nella sede di inserzione dei tendini, dei legamenti, delle strutture capsulo-legamentose e del disco intervertebrale.
Negli ultimi dieci anni si è assistito ad un importante sforzo volto ad identificare strumenti il più possibile riproducibili nella valutazione clinica dei pazienti affetti da SA. La valutazione dell’attività di malattia e della risposta al trattamento nella SA, restano compiti ineludibili che il reumatologo deve assolvere nella pratica clinica quotidiana, al fine di assicurare una corretta modulazione della strategia terapeutica, adattata all’andamento del processo infiammatorio. Allo stato attuale si ritiene che la frequenza del monitoraggio dovrebbe essere decisa su base individuale a seconda dei sintomi, della gravità e del trattamento farmacologico. Appare, pertanto, indispensabile che al di là delle valutazioni comunemente condotte in corso di trials clinici, il reumatologo, nella sua pratica clinica, disponga di strumenti di valutazione semplici e di facile computazione, adatti allo scopo. Il Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) è un indice autosomministrato per la valutazione dell’attività di malattia proposto e validato per le spondiloartriti, costituito da sei quesiti (o items) che indagano l’intensità del dolore a livello del collo, della schiena, delle anche e delle articolazioni periferiche, il dolore provocato dal contatto/ pressione, nonché l’intensità e la durata della rigidità mattutina. Le risposte, riportate su scale numeriche a 11 livelli, generano un punteggio compreso in un range da 0 a 10, dove 0 corrisponde ad una “attività assente” e 10 ad una “massima attività”. Il BASDAI è un test attendibile, sensibile al cambiamento e riflette l’intero quadro di malattia; è inoltre facilmente compreso dal paziente e necessità di solo pochi minuti per la compilazione. La recente introduzione degli indici compositi di valutazione dell’attività di malattia della SA, come ad esempio l’Ankylosing Spondilytis Disease Activity Score (ASDAS) (Figura 2), comprendenti sia misure soggettive (patient-reported outcomes) che parametri laboratoristici (quali la VES o la PCR), ha consentito di superare i limiti connessi all’impiego di uno strumento esclusivamente “paziente-centrato”. L’adozione di un “pool” di misure cliniche offre, infatti, innumerevoli vantaggi, fra cui figurano la non conflittualità (o non collinearità), la più efficace comparabilità fra pazienti o gruppi di pazienti e la maggiore potenza e sensibilità nel monitorare le variazioni cliniche nel tempo (o responsività). L’impiego di complessi algoritmi matematici consente il calcolo dei punteggi per i differenti set di misure composite. L’ASDAS-PCR, comprendente, cioè, i quesiti 2 (dolore del rachide), 3 (dolore delle articolazioni periferiche) e 6 (durata della rigidità mattutina) del BASDAI, unitamente all’autovalutazione dell’attività di malattia [Patient Global Assessment (PGA)] ed al logaritmo naturale della PCR (espressa in mg/l), ha dimostrato le migliori caratteristiche psicometriche. In caso di disponibilità della VES, piuttosto che della PCR, è possibile calcolare una differente versione dell’indice composito (ASDAS-VES). In entrambi i casi è possibile calcolare il valore dell’indice mediante le seguenti formule:
ASDAS-PCR: 0,121 x BASDAI(Q2) + 0,058 x BASDAI(Q6) + 0,110 x PGA+ 0,073 x BASDAI(Q3) + 0,579 x Ln (PCR+1)
ASDAS-VES: 0,079 x BASDAI(Q2) + 0,069 x BASDAI(Q6) + 0,113 x PGA +0,086 x BASDAI(Q3) + 0,293 x √VES
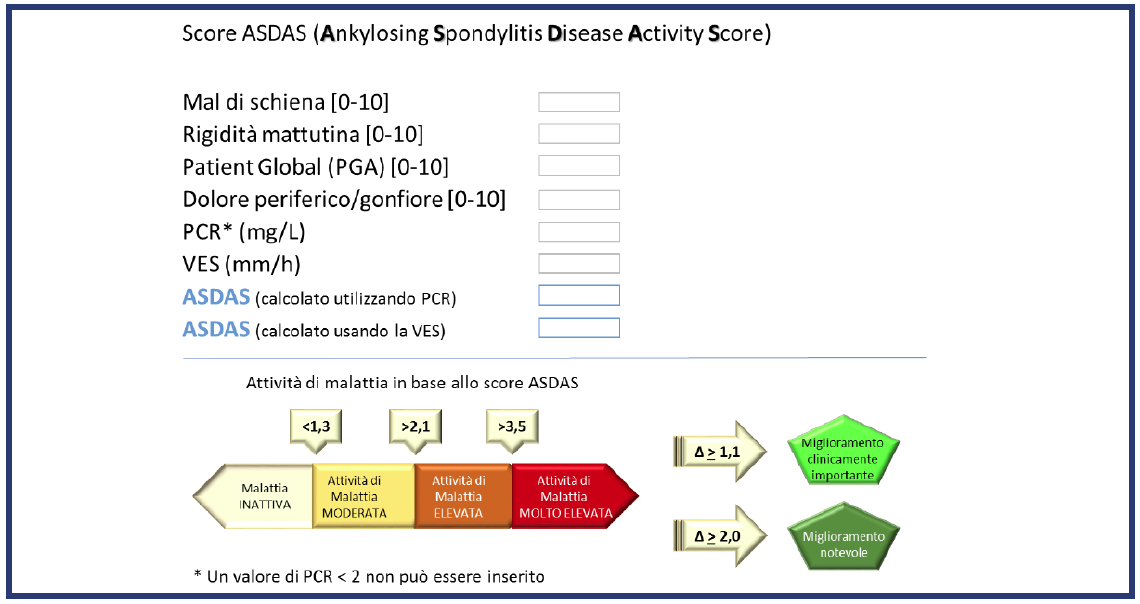 Figura 2. Score ASDAS e rispettivi criteri di gravità e di miglioramento clinico.
Figura 2. Score ASDAS e rispettivi criteri di gravità e di miglioramento clinico.
IL TRATTAMENTO DELLA SPONDILITE ANCHILOSANTE
Coerentemente con le linee-guida (LG) internazionali e nazionali, gli obiettivi primari del trattamento della SA sono il controllo dei segni e dei sintomi, la prevenzione della progressione del danno articolare, il mantenimento e/o la normalizzazione delle capacità funzionali, dell’abilità lavorativa e della partecipazione sociale, oltre alla riduzione delle complicanze della malattia, con il raggiungimento di uno stato di remissione della malattia o di una attività minima della stessa.
Poiché l’obiettivo di remissione non è sempre raggiungibile, in particolare nei pazienti con malattia di lunga durata, si raccomanda una strategia di monitoraggio del paziente ispirata al paradigma del treat to target, ovvero all’adeguamento della terapia sulla base dei risultati ottenuti e degli obiettivi terapeutici prestabiliti e personalizzati nel singolo paziente.
La terapia farmacologica della SA, secondo le principali LG internazionali, prevede il ricorso a:
- FANS;
- Glucocorticoidi (solo in caso di coinvolgimento periferico);
- DMARDs tradizionali (cDMARDs: sulfasalazina=SSZ; metotressato=MTX), in caso di presenza concomitante di artrite periferica;
- bDMARDs, in caso di inadeguata risposta al trattamento con FANS.
Per quanto concerne, la mancata risposta al trattamento di prima linea con FANS, recentemente le LG EULAR hanno inserito nelle raccomandazioni 2022, per il trattamento delle forme assiali, oltre all’uso dei bDMARDs anche il ricorso a JAK inibitori.
Come trattamento di prima linea per il controllo dei sintomi della SA, le LG nazionali raccomandano l’uso di almeno due FANS/ COXIB per un periodo di 4-6 settimane al dosaggio massimo tollerato, oltre ad infiltrazioni locali (intraarticolari o perientesitiche) di steroidi nelle forme oligoarticolari o entesitiche, in assenza di controindicazioni dovute alla sede. Le LG elaborate dalla Regione Emilia Romagna nel 2017 raccomandano di iniziare il trattamento con bDMARDs (anti-TNF alfa: adalimumab, certolizumab, etanercept, golimumab, infliximab originatori o biosimilari o un inibitore dell’IL-17A: secukinumab), considerando le vigenti condizioni di rimborsabilità del Servizio Sanitario Nazionale (SSN), nel rispetto delle indicazioni terapeutiche registrate ed in presenza di entrambe le seguenti condizioni:
- fallimento terapeutico ad almeno due cicli di FANS/ COXIB somministrati per un periodo di 46 settimane al dosaggio massimo tollerato;
- presenza di malattia attiva definita per la SA come segue: malattia attiva da >4 settimane e BASDAI >4.
In caso di risposta favorevole ai bDMARDs (valutata a 3 mesi dall’inizio del farmaco) il trattamento dovrà essere continuato. La valutazione della risposta, intesa come miglioramento relativo del BASDAI ≥50% o assoluto di ≥2 punti dovrà essere effettuata ogni 6 mesi. In caso di remissione prolungata (> 6 mesi) potrà essere presa in considerazione una lenta riduzione della posologia del bDMARD, fino anche all’eventuale sua sospensione. In caso di riacutizzazione della malattia si raccomanda di riprendere subito il trattamento.
Si specifica, inoltre, che il 3 agosto 2022, con Determina AIFA n. 545/2022, è stata aggiunta alle opportunità terapeutiche sopra indicate, anche il farmaco Upadacitinib (Rinvoq) indicato nel trattamento della SA attiva nei pazienti adulti che hanno avuto una risposta inadeguata alla terapia convenzionale.
Ad oggi persiste un problema importante per i pazienti con SA che si correla ad una appropriata gestione del dolore/fatica, sintomo dominante nel quadro clinico di questi pazienti, particolarmente acuto nelle fasi iniziali della patologia ma presente anche come dolore residuo nei pazienti in trattamento. Il dolore/fatica rappresenta un problema importante legato alla patologia in quanto si manifesta su diversi piani: fisico, psicologico e sociale. Lo stesso, infatti, determina nei pazienti disagio psicologico ed alterazioni del sonno, può essere causa di disabilità importante quanto il danno strutturale e può, inoltre, ostacolare l’attività produttiva dei pazienti in età lavorativa, sia in termini di assenteismo che di presenteismo (ovvero la presenza sul posto di lavoro anche in comprovate condizioni di malessere). Risulta, quindi, necessario migliorare il trattamento dei pazienti affetti da questa condizione patologica, ottimizzarne l’assistenza sanitaria e valutare pienamente l’impatto e il beneficio dei diversi approcci di gestione, in rapporto alla severità del quadro clinico presentato e dal relativo grado di attività della malattia, nonché del reale bisogno di salute del paziente che ne è affetto.
LA VALUTAZIONE ECONOMICA DELLA GESTIONE DEL MUSCOLO-SCHELETRICO CORRELATO ALLA SA IN ITALIA
La SA rappresenta un onere importante per l’assistenza sanitaria, non solo per l’evidente impatto clinico, epidemiologico e sociale ma anche per l’elevato carico di malattia legato ai costi, diretti e indiretti, generati dalla gestione della patologia stessa. Per affrontare le sfide attuali del nostro SSN, occorre riorganizzare il sistema tenendo in considerazione le esigenze di tutti gli stakeholder e ponendo al centro il “valore”. Nel 2019 l’Expert Panel on Effective Ways of Investing in Health (EXPH), istituito dalla Commissione Europea, ha proposto l’ assistenza sanitaria basata sul valore come un concetto completo fondato su quattro value-pillars: un’assistenza adeguata per raggiungere gli obiettivi personali dei pazienti (valore personale), il conseguimento di migliori risultati possibili con le risorse disponibili (valore tecnico), un’equa distribuzione delle risorse tra tutti i gruppi di pazienti (valore allocativo) e il contributo dell’assistenza sanitaria alla partecipazione e alla connessione sociale (valore sociale). Queste quattro dimensioni del “valore” assicurano i pilastri fondamentali dei sistemi sanitari basati sulla solidarietà: il principio di equità può essere assicurato da un’equa allocazione delle risorse, un’equa distribuzione può essere assicurata dal contributo dell’assistenza sanitaria alla coesione sociale, l’efficienza può essere garantita da un’ottimale allocazione delle risorse, la centralità del paziente e la qualità dell’assistenza possono essere garantite da una maggiore interazione tra medici e pazienti.
Risulta, pertanto, evidente l’esigenza di prendere in esame e mettere a fuoco anche un Sistema Value-based di assistenza dedicato alle persone con SA, con l’obiettivo di mettere concretamente il paziente al centro. Questa esigenza è strettamente collegata all’evidente impatto sociale di questa malattia e alle difficoltà crescenti di un SSN che, seppur attraversato da profonde trasformazioni organizzative e stretto nella morsa di una crescita esponenziale dei bisogni di salute, è chiamato ad assicurare una gestione unitaria e integrata di una patologia complessa come la SA.
Pertanto, in considerazione delle criticità caratterizzante l’attuale panorama sanitario, è stata effettuata un’analisi economica con l’obiettivo di determinare i costi legati alla gestione della SA in Italia. E’stata, inoltre, posta particolare attenzione alla gestione del dolore residuo nei pazienti affetti da SA, in trattamento con farmaci biologici (bDMARDs), quali anti-TNF alfa (adalimumab, certolizumab, etanercept, golimumab, infliximab originatori o biosimilari) e un inibitore dell’IL-17 (secukinumab).
Materiali e metodi
Partendo da un’analisi preliminare della letteratura scientifica sulle caratteristiche del percorso di cura e sull’assorbimento delle risorse per il trattamento della SA, è stata effettuata un’analisi di cost-of-illness, mediante applicazione della metodologia dell’Activity Based Costing (ABC), con l’obiettivo di determinare l’impatto, in termini di risorse assorbite, di una migliore gestione del dolore nei pazienti affetti da SA, nel setting assistenziale italiano. Il modello farmacoeconomico è basato sull’implementazione di un albero probabilistico in cui, per ciascuna strategia terapeutica considerata, ne è stata ponderata l’efficacia clinica in termini di score ASDAS e relativa spesa sanitaria. L’analisi economica ha considerato le seguenti macrocategorie di assorbimento risorse legate all’erogazione delle terapie oggetto di analisi:
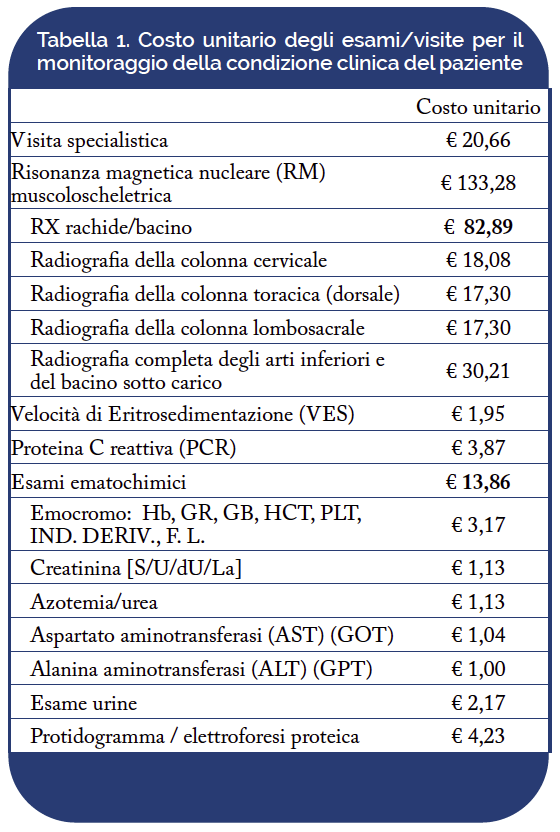
- costi di monitoraggio del paziente durante il periodo di follow-up (Tabella 1);
- costi di ricorso a prestazioni specialistiche per acuti (Tabella 2);
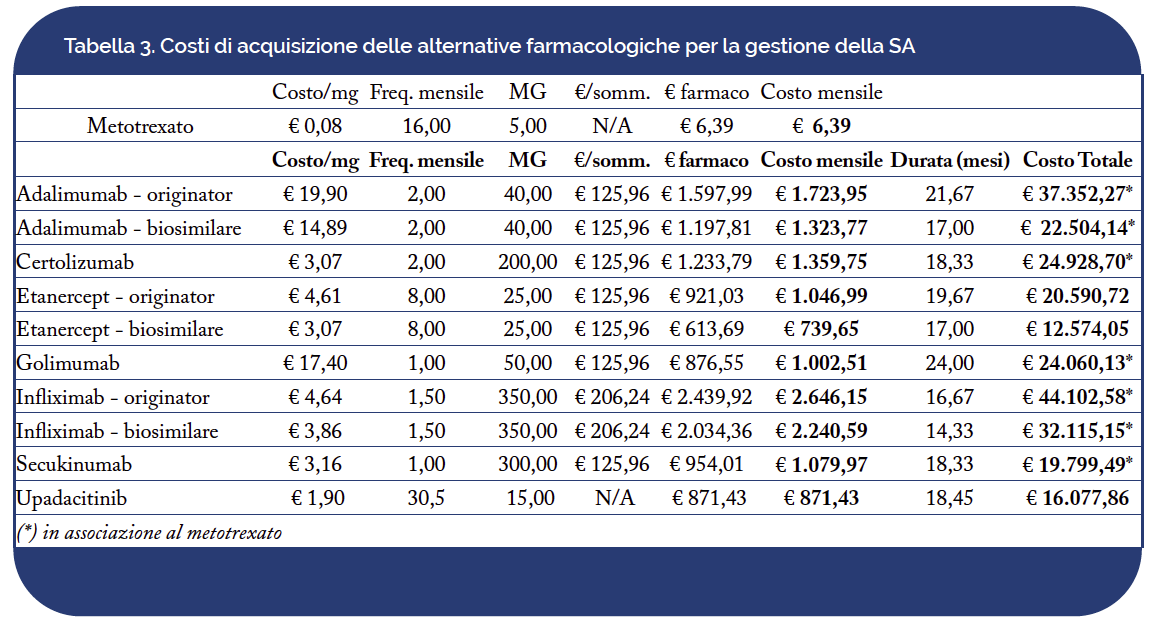
- costo di acquisizione delle terapie farmacologiche (Tabelle 3-4);
- costi indiretti: perdite di produttività del paziente e del suo caregiver per il supporto informale alla terapia (Tabella 5 assenteismo/presenteismo lavorativo).
Nell’accezione più ristretta il termine presenteismo indica la ripetuta presenza di collaboratrici o collaboratori sul posto di lavoro a prescindere da un comprovato stato di malattia (fisica o psichica); meno evidente dell’assenteismo e per questo molto spesso poco considerato dalle aziende, presenta costi per l’organizzazione simili all’assenteismo, se non maggiori.
Al fine di valutare l’impatto dell’incertezza sui risultati dell’analisi è stata realizzata un’analisi di sensibilità univariata in cui è stato ipotizzato un grado di incertezza caratterizzante i parametri considerati all’interno del modello economico, pari al 25% del loro valore medio considerato nello scenario base, per individuare i driver che comportano il maggiore scostamento dai risultati ottenuti nello scenario di riferimento.

Risultati
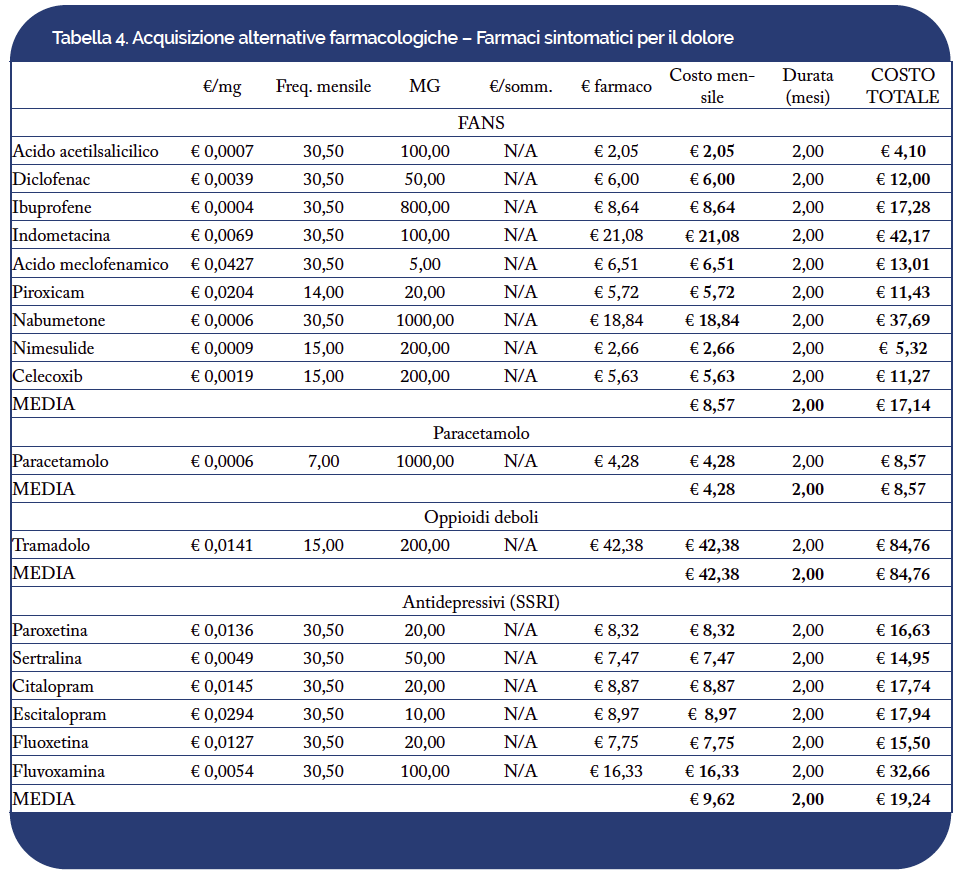
Dall’analisi dei farmaci specifici per la gestione del dolore correlato alla SA è emerso un costo maggiore per la macrocategoria farmacologica degli oppioidi deboli (€84,76), al contrario del paracetamolo che, con un costo complessivo di €8,57, è risultato essere il farmaco associato alla spesa più contenuta tra quelli considerati. Per la stima di tali costi, coerentemente a quanto indicato nelle LG internazionali, è stato preso come riferimento un tempo medio di gestione dei sintomi pari a due mesi (Tabella 4).
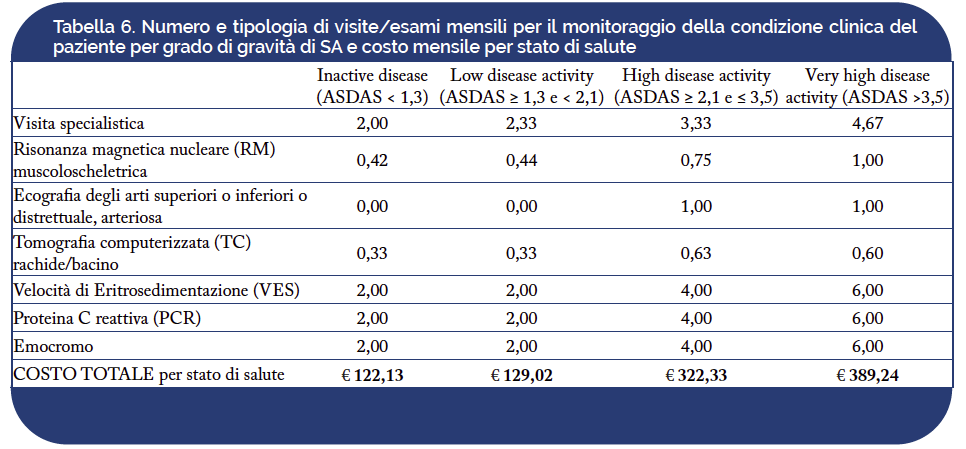
In Tabella 6 è riportato il numero e la tipologia di visite/esami mensili per il monitoraggio della condizione clinica del paziente per grado di gravità della patologia, così come emerso dalla consultazione, mediante survey, dei clinici coinvolti. Pesando il costo unitario di ciascuna prestazione per la relativa frequenza è stato possibile determinare la spesa media relativa al monitoraggio del paziente per livello di gravità della SA. Pazienti classificati con uno score ASDAS inferiore a 1,3 sono caratterizzate da un costo di follow-up pari a €122,13 mentre pazienti con score superiore a 3,5 sono associati ad una spesa media di €389,24. Le due classi intermedie si caratterizzano per un costo pari a €129,02 e €322,33 rispettivamente per gli stati low disease activity e high disease activity.
In Tabella 7 è riportato il tasso di ricorso ai ricoveri per grado di gravità della SA così come emerso dalla survey condotta. Pesando il costo unitario di ciascun ricovero per il relativo tasso è stato possibile determinare la spesa media relativa alla gestione in acuto del paziente per livello di gravità della SA. In particolare, si rileva come il ricorso al ricovero ospedaliero avvenga per pazienti caratterizzati da score ASDAS superiori a 2,1. Solo una quota marginale dei pazienti necessita di ricovero (Tabella 7).
Per quanto concerne i costi indiretti legati alla SA in Italia, è stato calcolato il numero di giornate perse da parte del caregiver su base mensile per il supporto informale al paziente affetto da SA (Tabella 8).
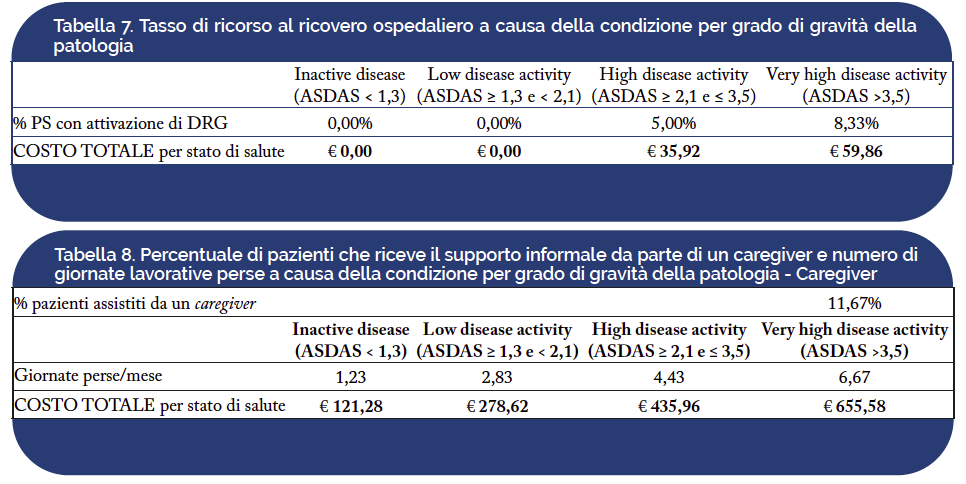
Dalla consultazione degli esperti, è emerso che l’11,67% dei pazienti affetti da SA riceve supporto da parte di un caregiver. Pesando il costo unitario per ora lavorativa persa e assumendo una media di cinque ore lavorative/die, è stato possibile determinare un range di giornate lavorative perse che varia da 1,23/mese per i caregiver di pazienti caratterizzati da score ASDAS <1,3 a 6,67/mese per quelli di pazienti con score ASDAS >3,5. In termini di costi correlati alla perdita di produttività annuale da parte del caregiver, per le stesse classi di pazienti sono stati riscontrati valori variabili tra €121,28 e €655,58.
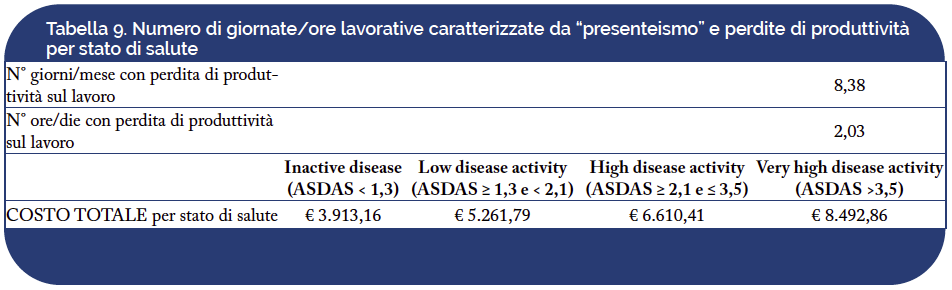
Inoltre, assumendo anche per il paziente con SA una media di cinque ore lavorative/die, è stato possibile determinare la perdita di produttività media associabile alla malattia e al suo livello di gravità, e relativa sia al presenteismo sia all’assenteismo, rilevando costi indiretti annui variabili da €3.913,16 per pazienti con score ASDAS <1,3 a €8.492,86 per i pazienti con score ASDAS >3,5 (Tabella 9).
Dall’analisi di tutti i parametri considerati nello studio, nonché del costo unitario di ciascuno di essi, è stato possibile determinare, quindi, il costo totale di gestione del paziente con SA: i trattamenti risultano associati ad un assorbimento di risorse per ciascun paziente pari in media a €30.340,27. Se si escludessero i costi di acquisizione delle strategie farmacologiche, una migliore gestione del dolore consentirebbe una riduzione del costo medio di gestione del paziente con SA di €602,67. Al netto dei costi associati ai farmaci, la voce di costo maggiormente impattante sulla spesa totale è quella relativa al follow-up del paziente.
Discussione
La presente analisi ha valutato l’impatto economico legato alla gestione del paziente affetto da SA, secondo la prospettiva del SSN (terzo pagante) e dell’intera società. È stato, quindi, sviluppato un modello di cost-of-illness volto a quantificare il costo di gestione di un paziente con SA mediante ricorso alle alternative farmacologiche oggi disponibili nel setting assistenziale italiano, e ponendo particolare attenzione ai costi legati alla gestione del dolore, sintomo importante nel quadro clinico dei pazienti con SA, che impatta notevolmente sulla loro qualità di vita, ostacolandone in molti casi anche l’attività lavorativa, in termini di assenteismo e presenteismo, e causando riduzione della funzione fisica e anche disabilità psicosociale.
Dal confronto tra gli scenari definiti nel modello è emerso che in Italia un’adeguata gestione terapeutica della malattia comporterebbe una riduzione dei costi, escludendo i costi di acquisizione delle alternative farmacologiche, pari a €602,67 per paziente. L’impatto maggiore, in termini di risparmio di risorse, legato ad una migliore gestione del dolore, si ha sui costi indiretti (€538,54 per pz).
Nei pazienti con SA livelli eccessivi di dolore possono essere persistenti nel tempo, essendo il risultato di un’infiammazione articolare in corso che potrebbe essere anche subclinica e non facilmente rilevabile. Questo dolore continuo riferito dai pazienti può mantenersi nel tempo anche a fronte del controllo dell’infiammazione, indotto dal trattamento impiegato per la SA e, pertanto, l’adozione di una terapia farmacologica avente come bersaglio anche il dolore persistente potrebbe garantire un maggiore beneficio terapeutico per i pazienti. Dal momento che il dolore rappresenta una componente sintomatologica importante della SA, agenti che prendono di mira anche questo sintomo possono rivelarsi maggiormente efficaci sull’attività complessiva della malattia articolare, impattando positivamente anche sui costi di gestione della stessa.
Tra i principali limiti dello studio si annovera il fatto che, non essendo disponibile un dato relativo alla durata real life della terapia basata su upadacitinib, è stato considerato il periodo di follow-up del trial clinico da cui sono stati reperiti i risultati di efficacia clinica del farmaco. Inoltre, ai farmaci infliximab e secukinumab, in mancanza di una evidenza che informasse sulla distribuzione finale dei pazienti tra le quattro classi della scala ASDAS, è stato associato il valore medio di efficacia reperito per gli altri farmaci oggetto di analisi. Infine, si riporta la possibilità di ottimizzare la stima relativa ai costi indiretti (perdite di produttività) mediante il possibile coinvolgimento di associazioni dei pazienti in grado di fornire stime più accurate in merito all’impatto che la patologia ha sull’assenza da lavoro del paziente e del caregiver.
I dati riguardanti l’efficacia delle alternative terapeutiche considerate sono state reperite mediante estrapolazione dalle evidenze scientifiche disponibili in letteratura. Inoltre, è stata impiegata una metodologia farmacoeconomica rigorosa, in grado di restituire la stima più precisa dei costi associati all’impiego delle alternative farmacologiche oggetto di analisi. Il profilo di consumo delle risorse sanitarie riguardanti il follow-up, il ricorso al ricovero e la gestione del dolore è stata basata su una survey che ha visto coinvolti key opinion leader di comprovata esperienza nella gestione di pazienti con SA nel contesto assistenziale italiano. Infine, per ovviare alla mancanza di robustezza associata ad alcuni dei valori considerati nella presente analisi è stata condotta un’analisi di sensitività univariata.
In un contesto, come quello attuale, caratterizzato dalla necessità di efficientamento della gestione delle risorse economiche del SSN, risulta cruciale il ricorso ad alternative terapeutiche che, a parità di impatto clinico sul paziente, consentano di ridurre i costi e di generare un valore sociale. Il tutto al fine di proporre un Sistema Value-Based di assistenza dedicato alle persone con SA con l’obiettivo di mettere concretamente il paziente al “centro”. Questa esigenza è strettamente collegata all’evidente impatto sociale di questa condizione patologica che necessita di politiche sanitarie responsabili, finalizzate alla implementazione di nuovi modelli gestionali in grado di rispondere adeguatamente ai bisogni di salute dei pazienti affetti da SA.
Punti chiave
- La SA rappresenta un onere importante per l’assistenza sanitaria, non solo per l’evidente impatto clinico, epidemiologico e sociale ma anche per l’elevato carico di malattia legato ai costi, diretti e indiretti, generati dalla gestione della patologia stessa.
- Un problema importante per i pazienti con SA è rappresentato da una appropriata gestione del dolore/fatica, sintomo dominante nel quadro clinico dei pazienti, particolarmente acuto nelle fasi iniziali della patologia ma presente anche come dolore residuo nei pazienti in trattamento.
- Dall’analisi di cost-of-illness condotta è emerso che l’adozione di un’adeguata gestione farmacologica della SA, nel setting italiano, avente come bersaglio anche il dolore persistente associato alla malattia, potrebbe garantire da un lato un maggiore beneficio terapeutico per i pazienti e dall’altro comporterebbe una riduzione dei costi – escludendo quelli di acquisizione delle alternative farmacologiche – pari a €602,67 per paziente, con un impatto maggiore, in termini di risparmio di risorse, sui costi indiretti (€538,54 per pz).
Bibliografia
- Epicentro – ISS. Artriti. Disponibile online: https://www. epicentro.iss.it/artriti/.
- Basile M, Rumi F, Palmeri M, Mattozzi I, Manzoli L, Mammucari M, Gigliotti S, Bernabei R, Cicchetti A. Il burdeneconomico dell’inappropriatezza prescrittiva nella gestione dell’osteoartrite in Italia. Glob Reg Health Technol Assess 2020; 7(1): 101-108; DOI: 10.33393/grhta.2020.2130
- Società Italiana di Reumatologia (SIR). Classificazione delle malattie reumatologiche della Società Italiana di Reumatologia. Reumatismo. 2019; Vol. 71, Supplemento 2.
- Woolf AD, Pfleger B. Burden of major musculoskeletal conditions. Bull World Health Organ. 2003;81(9):646-56.
- National Institute for Health and Care Excellence. Spondyloarthritis in over 16s: diagnosis and management. February 2017. Disponibile online: www.nice.org.uk/ guidance/ng65
- Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis. 2022;0:1–16. doi:10.1136/ard-2022-223296
- Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis. 2020;79:700–712. doi:10.1136/annrheumdis-2020-217159
- Mogard E, Bremander A, Lindqvist E, Bergman S. Prevalence of chronic widespread pain in a population-based cohort of patients with spondyloarthritis – a cross-sectional study. BMC Rheumatol. 2018 Apr 5;2:11. doi: 10.1186/ s41927-018-0018-7.
- Gruppo multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia-Romagna. Linee guida terapeutiche- Trattamento farmacologico della spondilite anchilosante e delle spondiloartriti assiali non radiografiche nell’adulto, con particolare riferimento ai farmaci biologici. Aggiornamento Ottobre 2017. Disponibile online: https://salute.regione. emilia-romagna.it/ssr/strumenti-e-informazioni/ptr/elaborati/277-lg-11-spondilite-anchilosante-e-spondiloartriti-assiali-non-radiografiche-2017
- Rudwaleit M, van der Heijde D, Landewé R, Listing J, Akkoc N, Brandt J, Braun J, Chou CT, Collantes-Estevez E, Dougados M, Huang F, Gu J, Khan MA, Kirazli Y, Maksymowych WP, Mielants H, Sørensen IJ, Ozgocmen S, Roussou E, Valle-Oñate R, Weber U, Wei J, Sieper J. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis. 2009 Jun;68(6):777-83. doi: 10.1136/ard.2009.108233.
- Lukas C, Landewé R, Sieper J, Dougados M, Davis J, Braun J, van der Linden S, van der Heijde D; Assessment of SpondyloArthritis international Society. Development of an ASAS-endorsed disease activity score (ASDAS) in patients with ankylosing spondylitis. Ann Rheum Dis. 2009 Jan;68(1):18-24. doi: 10.1136/ard.2008.094870.
- van der Heijde D, Lie E, Kvien TK, Sieper J, Van den Bosch F, Listing J, Braun J, Landewé R; Assessment of SpondyloArthritis international Society (ASAS). ASDAS, a highly discriminatory ASAS-endorsed disease activity score in patients with ankylosing spondylitis. Ann Rheum Dis. 2009 Dec;68(12):1811-8. doi: 10.1136/ard.2008.100826.
- Machado P, Landewé R, Lie E, Kvien TK, Braun J, Baker D, van der Heijde D; Assessment of SpondyloArthritis international Society. Ankylosing Spondylitis Disease Activity Score (ASDAS): defining cut-off values for disease activity states and improvement scores. Ann Rheum Dis. 2011 Jan;70(1):47-53. doi: 10.1136/ard.2010.138594.
- Smolen JS, Braun J, Dougados M, Emery P, Fitzgerald O, Helliwell P, Kavanaugh A, Kvien TK, Landewé R, Luger T, Mease P, Olivieri I, Reveille J, Ritchlin C, Rudwaleit M, Schoels M, Sieper J, Wit Md, Baraliakos X, Betteridge N, Burgos-Vargas R, Collantes-Estevez E, Deodhar A, Elewaut D, Gossec L, Jongkees M, Maccarone M, Redlich K, van den Bosch F, Wei JC, Winthrop K, van der Heijde D. Treating spondyloarthritis, including ankylosing spondylitis and psoriatic arthritis, to target: recommendations of an international task force. Ann Rheum Dis. 2014 Jan;73(1):6-16. doi: 10.1136/annrheumdis-2013-203419.
- Braun J, van den Berg R, Baraliakos X, Boehm H, Burgos-Vargas R, Collantes-Estevez E, Dagfinrud H, Dijkmans B, Dougados M, Emery P, Geher P, Hammoudeh M, Inman RD, Jongkees M, Khan MA, Kiltz U, Kvien T, Leirisalo-Repo M, Maksymowych WP, Olivieri I, Pavelka K, Sieper J, Stanislawska-Biernat E, Wendling D, Ozgocmen S, van Drogen C, van Royen B, van der Heijde D. 2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis. 2011 Jun;70(6):896-904. doi: 10.1136/ard.2011.151027
- van der Heijde D, Sieper J, Maksymowych WP, Dougados M, Burgos-Vargas R, Landewé R, Rudwaleit M, Braun J; Assessment of SpondyloArthritis international Society. 2010 Update of the international ASAS recommendations for the use of anti-TNF agents in patients with axial spondyloarthritis. Ann Rheum Dis. 2011 Jun;70(6):905-8. doi: 10.1136/ ard.2011.151563.
- Rohekar S, Chan J, Tse SM, Haroon N, Chandran V, Bessette L, Mosher D, Flanagan C, Keen KJ, Adams K, Mallinson M, Thorne C, Rahman P, Gladman DD, Inman RD. 2014 Update of the Canadian Rheumatology Association/Spondyloarthritis Research Consortium of Canada Treatment Recommendations for the Management of Spondyloarthritis. Part II: Specific Management Recommendations. J Rheumatol. 2015 Apr;42(4):665-81. doi: 10.3899/jrheum.141001.
- Ward MM, Deodhar A, Akl EA, Lui A, Ermann J, Gensler LS, Smith JA, Borenstein D, Hiratzka J, Weiss PF, Inman RD, Majithia V, Haroon N, Maksymowych WP, Joyce J, Clark BM, Colbert RA, Figgie MP, Hallegua DS, Prete PE, Rosenbaum JT, Stebulis JA, Van Den Bosch F, Yu DT, Miller AS, Reveille JD, Caplan L. American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis Care Res (Hoboken). 2016 Feb;68(2):151-66. doi: 10.1002/acr.22708.
- Expert Panel on Effective Ways of Investing in Health (EXPH). Opinion on Defining value in “value-based healthcare”. 2019. Disponibile online: https://ec.europa.eu/health/ sites/default/files/expert_panel/docs/024_defining-value-vbhc_en.pdf
- Hodgson TA, Meiners MR. Cost-of-illness methodology: a guide to current practices and procedures. Milbank Mem Fund Q Health Soc. 1982 Summer;60(3):429-62.
- Geisler BP, Siebert U, Gazelle GS, Cohen DJ, Göhler A. Deterministic sensitivity analysis for first-order Monte Carlo simulations: a technical note. Value Health. 2009 Jan- Feb;12(1):96-7. doi: 10.1111/j.1524-4733.2008.00411.x.
- Huang F, Gu J, Zhu P, Bao C, Xu J, Xu H, Wu H, Wang G, Shi Q, Andhivarothai N, Anderson J, Pangan AL. Efficacy and safety of adalimumab in Chinese adults with active ankylosing spondylitis: results of a randomised, controlled trial. Ann Rheum Dis. 2014 Mar;73(3):587-94. doi: 10.1136/annrheumdis-2012-202533.
- Landewé R, Braun J, Deodhar A, Dougados M, Maksymowych WP, Mease PJ, Reveille JD, Rudwaleit M, van der Heijde D, Stach C, Hoepken B, Fichtner A, Coteur G, de Longueville M, Sieper J. Efficacy of certolizumab pegol on signs and symptoms of axial spondyloarthritis including ankylosing spondylitis: 24-week results of a double-blind randomised placebo-controlled Phase 3 study. Ann Rheum Dis. 2014 Jan;73(1):39-47. doi: 10.1136/annrheumdis-2013-204231
- Baraliakos X, Haibel H, Fritz C, Listing J, Heldmann F, Braun J, Sieper J. Long-term outcome of patients with active ankylosing spondylitis with etanercept-sustained efficacy and safety after seven years. Arthritis Res Ther. 2013;15(3):R67. doi: 10.1186/ar4244.
- van der Heijde D, Deodhar A, Braun J, Mack M, Hsu B, Gathany TA, Inman RD, Han C; GO-RAISE investigators. The effect of golimumab therapy on disease activity and health-related quality of life in patients with ankylosing spondylitis: 2-year results of the GO-RAISE trial. J Rheumatol. 2014 Jun;41(6):1095-103. doi: 10.3899/jrheum.131003.
- van der Heijde D, Song IH, Pangan AL, Deodhar A, van den Bosch F, Maksymowych WP, Kim TH, Kishimoto M, Everding A, Sui Y, Wang X, Chu AD, Sieper J. Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT-AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet. 2019 Dec 7;394(10214):2108-2117. doi: 10.1016/S0140- 6736(19)32534-6.
- Ministero della Salute. Tariffario delle prestazioni di assistenza ambulatoriale. Disponibile online: http://www.salute.gov. it/portale/temi/p2_6.jsp?id=1767&area=programmazioneSanitariaLea&menu=lea
- Ministero della Salute. Tariffario delle prestazioni di assistenza per acuti. Disponibile online: http://www.salute.gov.it/ portale/temi/p2_6.jsp?lingua=italiano&id=3662&area=programmazioneSanitariaLea&menu=vuoto
- Job Pricing: All About Rewards. Salary Outlook 2019: L’analisi del mercato retributivo Italiano – dati aggiornati al secondo semestre 2018. Disponibile online: https://www.jobpricing.it/blog/project/salary-outlook-2019-prima-edizione
- Ritchlin C, Adamopoulos IE. Axial spondyloarthritis: new advances in diagnosis and management. BMJ. 2021 Jan 4;372:m4447. doi: 10.1136/bmj.m4447.
Pubblicazione realizzata con il supporto incondizionato di AbbVie Italia
