L’AREA TRASVERSA DEL NERVO SURALE IN PAZIENTI CON FIBROMIALGIA: UN POSSIBILE CAMPO DI APPLICAZIONE DELL’ECOGRAFIA NELLA DEFINIZIONE DI UN SOTTOTIPO DI PAZIENTI CON INTERESSAMENTO DEL SISTEMA NERVOSO PERIFERICO
AUTORI:
Marco Di Carlo1, Claudio Ventura2, Pietro Cesaroni1, Marina Carotti2, Fausto Salaffi1
Introduzione
La fibromialgia (FM) è una condizione caratterizzata dalla presenza di dolore muscolo-scheletrico diffuso associato ad astenia, facile stancabilità, a cui può associarsi un corteo sintomatologico caratterizzato dalla presenza di disturbi “funzionali” (alterazioni del sonno, ansia o depressione, sindrome del colon irritabile, cefalea, dismenorrea), in assenza di alterazioni ematochimiche o strumentali. Ad oggi, l’eziologia della FM non è nota: tra le varie ipotesi si ricordano: la presenza di alterazioni della fibrocellula muscolare, l’insorgenza di infezioni, il rilascio patologico di neurotrasmettitori che intervengono nella modulazione del dolore, l’alterazione dell’habitus psicologico del paziente, il possibile coinvolgimento del sistema neuroendocrino, del sistema nervoso centrale (SNC) e del sistema nervoso periferico (SNP). In questo lavoro è stata analizzata quest’ultima ipotesi eziopatogenetica. In particolare, diversi studi hanno documentato la presenza di neuropatia a piccole fibre (small fiber neuropathy – SFN) in una percentuale significativa di pazienti con FM (1). La prevalenza di SFN sembra essere circa il 40-49% nei pazienti con FM (2) (3).
Ecografia neuromuscolare
L’ecografia (US) ad alta risoluzione, che si pratica con sonde ad alta frequenza (12- 19 MHz), è in grado di dare informazioni sia di tipo funzionale che di tipo anatomico. La US neuromuscolare (NMUS) ad alta risoluzione è un esame a basso costo, facilmente ripetibile ed accessibile al paziente, e ben tollerato. La NMUS è utile in numerose patologie del SNP che, spesso, colpiscono anche i giovani, ad esempio: nella sindrome del tunnel carpale, nella sindrome da intrappolamento del nervo ulnare al gomito, in patologie gravemente invalidanti come le lesioni del plesso brachiale e di altri nervi dovute, ad esempio, a traumi. La NMUS può essere utile anche nella diagnosi di neuropatie autoimmuni, diabetiche o ereditarie come la Charcot-Marie-Tooth (CMT) o Hereditary Motor and Sensory Neuropathy (HMSN). Un lavoro interessante, eseguito su pazienti con SFN ma al di fuori della FM, ha documentato come la SFN sia associata ad un aumento dell’area della sezione trasversa (cross-sectional area – CSA) del nervo surale rispetto a volontari sani (4). Il nervo surale è un piccolo nervo con la funzione sensoriale e, dal punto di vista ecografico, è una struttura facilmente accessibile. Le attuali tecniche diagnostiche consentono anche un’eccellente definizione delle strutture nervose, anche se di dimensioni millimetriche (5). Nel campo delle malattie dei nervi periferici, la US è una tecnica diagnostica sempre più accettata, e si stanno aprendo aree innovative di ricerca in questo settore (6). Nel nostro lavoro, tramite la US è stata valutata l’associazione tra la FM e la SFN, mediante la misurazione del nervo surale.
Obiettivi dello studio
Gli obiettivi che il presente lavoro si è proposto sono: la valutazione delle dimensioni del nervo surale tramite NMUS nei pazienti FM, dal momento che le dimensioni del nervo surale possono indicare un quadro di SFN; l’identificazione di un possibile cluster di pazienti con potenziale coinvolgimento del SNP.
Metodi
SETTING E PAZIENTI
Il presente studio è stato condotto nel periodo compreso tra giugno e dicembre 2019, in cui sono stati arruolati consecutivamente pazienti affetti da FM in un centro di reumatologia di terzo livello che rappresenta il riferimento regionale per la diagnosi e il trattamento della FM. La diagnosi di FM, formulata secondo i criteri ACR 2016 (7), è stata effettuata in tutti i pazienti da un reumatologo con oltre trent’anni di esperienza nella gestione della FM. Per ciascun paziente sono stati raccolti dati demografici, in particolare peso e altezza, al fine di calcolare l’indice di massa corporea (body mass index – BMI), le comorbidità e l’attuale terapia farmacologica. In questo studio sono stati presi in considerazione solo i pazienti adulti, indipendentemente dallo stato di gravità della malattia, e ne sono state escluse le seguenti categorie: pazienti con malattie neurologiche note che colpiscono il SNP o il SNC (ossia polineuropatie, morbo di Parkinson, morbo di Alzheimer o altre demenze); pazienti con patologie internistiche o reumatologiche che possono portare al coinvolgimento delle piccole fibre nervose (es. diabete mellito di tipo II, insufficienza renale cronica, endocrinopatie non controllate, neoplasie in corso, infezioni da HIV-HBV-HCV, vasculiti o malattie del tessuto connettivo); pazienti con uso corrente o precedente di farmaci che inducono neuropatie; pazienti con condizioni che possono interferire con la valutazione clinica (ad es. sono stati esclusi i pazienti affetti da una concomitante artropatia infiammatoria in una fase di elevata attività di malattia o da una grave artrosi sintomatica); pazienti che in precedenza erano stati sottoposti a stripping della vena piccola safena per il trattamento delle vene varicose, data la possibilità, seppur remota, che questa procedura potesse aver indotto un danno al nervo surale (8). Tutti i pazienti hanno firmato il consenso informato scritto, accettando quindi di partecipare allo studio. I pazienti sono stati sottoposti ad una valutazione clinica durante la visita reumatologica per identificare due parametri: la gravità della malattia, utilizzando il revised Fibromyalgia Impact Questionnaire (FIQ-R), e l’identificazione della presenza e della severità del dolore neuropatico utilizzando il PainDetect Questionnaire (PDQ).
VALUTAZIONE ECOGRAFICA NEUROMUSCOLARE DEL NERVO SURALE
L’esame NMUS del nervo surale è stato condotto da due esperti ecografisti, rispettivamente un reumatologo con 10 anni di esperienza sull’US muscoloscheletrica e un radiologo con cinque anni di esperienza nel medesimo ambito. Entrambi gli operatori hanno condotto in cieco la valutazione US rispetto al quadro clinico e clinimetrico effettuata in ciascun paziente. Grazie ad una sessione di formazione preliminare di quattro ore, in cui i due medici hanno valutato insieme 10 soggetti sani e 10 pazienti FM (non considerati nell’analisi finale) sotto la supervisione di un radiologo con oltre 20 anni di esperienza sull’US muscoloscheletrica, è stato possibile trovare un accordo sulla modalità di svolgimento dell’esame NMUS. Al termine di questa formazione preliminare, entrambi gli operatori sono stati in grado di identificare il nervo surale in modo indipendente e di misurarne la circonferenza e la CSA.
Per lo svolgimento dell’esame NMUS, il paziente veniva invitato a sistemarsi in decubito prono, con i piedi fuori dal lettino. In seguito, veniva registrato il punto di riferimento su cui poi sarebbero state effettuate le misurazioni, ossia nella regione posteriore del polpaccio a 14 cm dall’apice del malleolo (prassi adottata in quanto, a questo livello, il nervo surale è una piccola struttura che decorre posteriormente al tendine piatto del muscolo gastrocnemio ed è rilevabile nelle immediate vicinanze della vena piccola safena (Figura 1)).
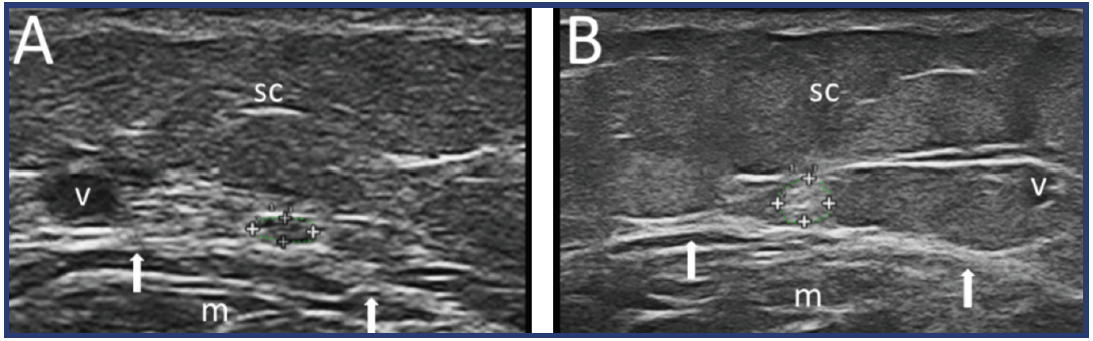
Figura 1. Immagini ecografiche del nervo surale nella porzione laterale e distale della gamba. 1A-CSA del nervo surale= 1 mm2 in una donna di 54 anni, con BMI = 20,0 Kg / M2 E PDQ = 9. 1B-CSA del nervo surale= 8 mm2 in una donna di 32 anni, con BMI = 35,9 Kg / M2 E PDQ = 25. Si noti anche in B la maggiore rappresentazione del tessuto sottocutaneo. Legenda: nervo surale sagomato all’interno dei segni +; v = piccola vena safena; m = muscolo gastrocnemio; frecce = margine del muscolo gastrocnemio; sc = tessuto sottocutaneo.
La decisione di misurare il nervo surale in questo preciso punto è stata presa da quanto già descritto in un lavoro sul coinvolgimento nervoso periferico nelle vasculiti dei piccoli vasi (9). La vena piccola safena è facilmente identificabile tramite US (5). Una volta stabilito questo punto di riferimento, iniziava lo svolgimento dell’esame NMUS, quindi, localizzato il nervo surale, si acquisiva l’immagine, e su di essa venivano effettuale le misurazioni a mano libera della circonferenza (espressa in mm) e della CSA (espressa in mm2). Entrambi i parametri venivano misurati tre volte, e per lo studio veniva preso in considerazione il valore medio derivato da queste tre misurazioni. A questo punto si ripeteva l’esame sull’arto inferiore controlaterale con le stesse modalità appena descritte. I risultati venivano salvati in un database realizzato appositamente per lo svolgimento di questo esame. Grazie allo studio anche del Power Doppler del nervo surale, è stato possibile completare e arricchire lo studio delle regioni perineurali, identificando possibili segni infiammatori. Il reumatologo ha eseguito il NMUS utilizzando un My-Lab Class C (Esaote S.p.A, Genova, Italia) dotato di una sonda a banda larga multifrequenza a 6-18 MHz, mentre il radiologo ha utilizzato un Epiq 5 (Philips) dotato di una sonda a banda larga multifrequenza a 4-18 MHz.
ANALISI STATISTICA
I dati di questo studio sono presentati con una statistica descrittiva comprensiva di media e deviazione standard (DS) per le variabili con distribuzione parametrica, e mediana e range interquartile per i dati con distribuzione non parametrica. Le correlazioni tra le variabili sono state studiate attraverso il test di correlazione di Pearson. Per verificare l’obiettivo dello studio, in particolare per identificare l’associazione delle variabili studiate con la CSA del nervo surale, è stata inizialmente condotta un’analisi unidirezionale della varianza (one-way analysis of variance – ANOVA). Quindi, per studiare le variabili (variabili indipendenti) associate all’aumento della CSA del nervo surale (variabile dipendente), è stata condotta un’analisi di regressione multipla. Tra le variabili indipendenti sono state considerate le variabili demografiche come l’età e il BMI e le variabili cliniche, tra cui la durata della malattia, la gravità della malattia (misurata come punteggio FIQ-R) e le caratteristiche del dolore neuropatico (valutate attraverso il PDQ). Come variabile indipendente è stato considerato il valore medio di CSA tra il lato destro e sinistro del corpo. Poiché le misurazioni NMUS sono state eseguite da due operatori separati, l’affidabilità tra gli osservatori è stata calcolata attraverso il coefficiente di correlazione intraclasse (intraclass correlation coefficient – ICC) su un campione di pazienti valutati da entrambi gli ecografisti. Valori significativi di p erano considerati <0,05. Le analisi statistiche sono state eseguite utilizzando MedCalc 18.0.0.
Risultati
Lo studio è stato condotto su 110 pazienti, rispettivamente 105 donne (94,5%) e 5 uomini, con un’età media (± DS) di 51,02 (± 11,20) anni. La durata media della FM (± DS) è 5,76 (± 5,23) anni. Per quanto riguarda il trattamento farmacologico, 64 pazienti (58,2%) sono stati trattati con pregabalin (ad un dosaggio di almeno 150 mg / die), 54 pazienti (49,1%) sono stati trattati con duloxetina (60 mg / die); tra questi, 28 pazienti (25,5%) erano in terapia con combinazione pregabalin + duloxetina.
Il valore medio di BMI risultava essere 28,07 (±6,08) Kg / m2. Rispettivamente 43 pazienti (39,09%) avevano un BMI normale (tra 18,5 e 24,9 Kg / m2), 26 pazienti (23,63%) erano in sovrappeso (BMI tra 25,0 e 30 Kg / m2), mentre 41 pazienti (37,27%) erano obesi (BMI superiore a 30,1 Kg / m2).
Per quanto riguarda la gravità della malattia, il punteggio medio (± DS) del FIQ-R era 64,17 (±19,01). Anche la presenza di caratteristiche tipiche del dolore neuropatico è risultata elevata, con un punteggio PDQ medio (± DS) di 20,48 (± 6,62). Rispettivamente, in 66 pazienti (60,0%) è stata documentata un’alta probabilità di dolore neuropatico, in 30 pazienti (27,3%) è stato riscontrato un risultato ambiguo, mentre in 14 pazienti (12,7%) è stata rivelata una bassa probabilità di caratteristiche di dolore neuropatico. L’esame NMUS del nervo surale ha documentato una circonferenza media (± DS) di 6,92 (± 6,70) mm e una CSA media di 2,94 (± 2,52) mm2. Utilizzando la tecnica Power Doppler, non è emersa in alcun nervo studiato la presenza di un’iperemia patologica.
I risultati delle correlazioni (Tabella 2) hanno mostrato che è stata rilevata un’alta correlazione tra la circonferenza media e le misurazioni CSA medie (r = 0,945, p <0,0001) nella valutazione delle dimensioni del nervo surale. Entrambe le misurazioni erano significativamente correlate (p <0,0001) con BMI e PDQ.
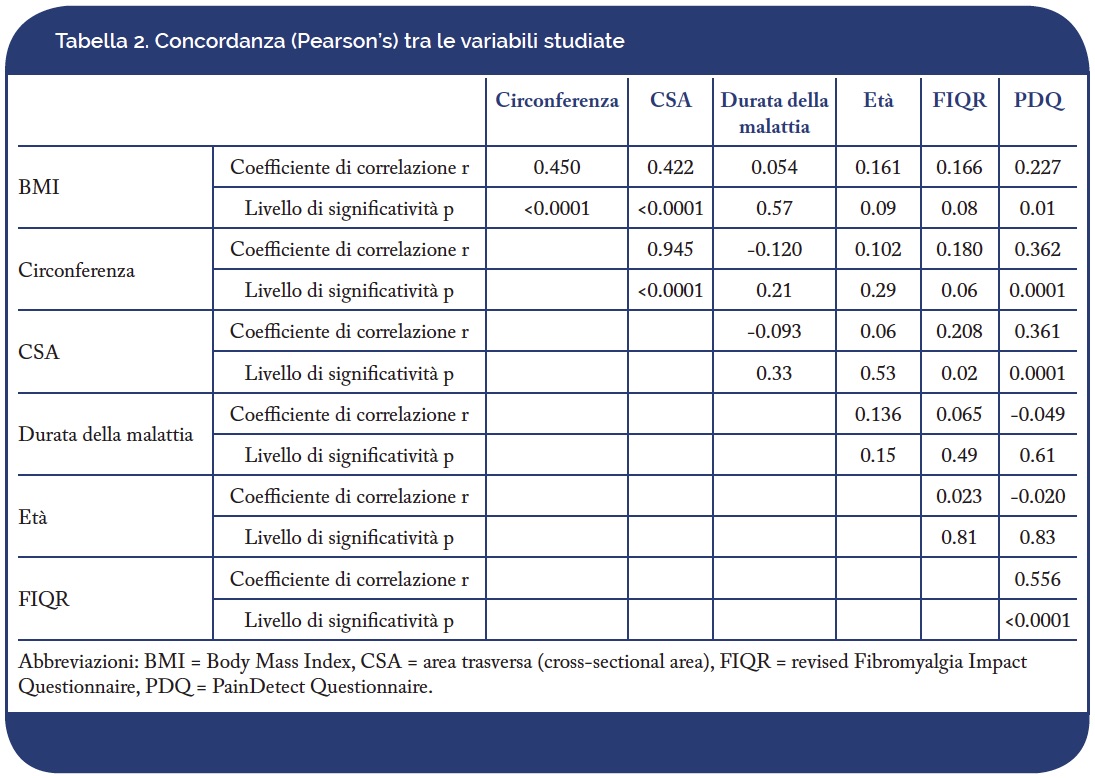
Una leggera correlazione, ai limiti di significatività (p= 0,02), è stata trovata tra CSA e FIQ-R. Tra le variabili studiate attraverso ANOVA, le uniche due variabili associate alla CSA del nervo surale erano il BMI e il PDQ. Entrambe le categorie di BMI (p <0,001) (Figura 2A) e PDQ (p = 0,003) (Figura 2B) hanno mostrato differenze statisticamente significative in relazione al CSA del nervo surale.
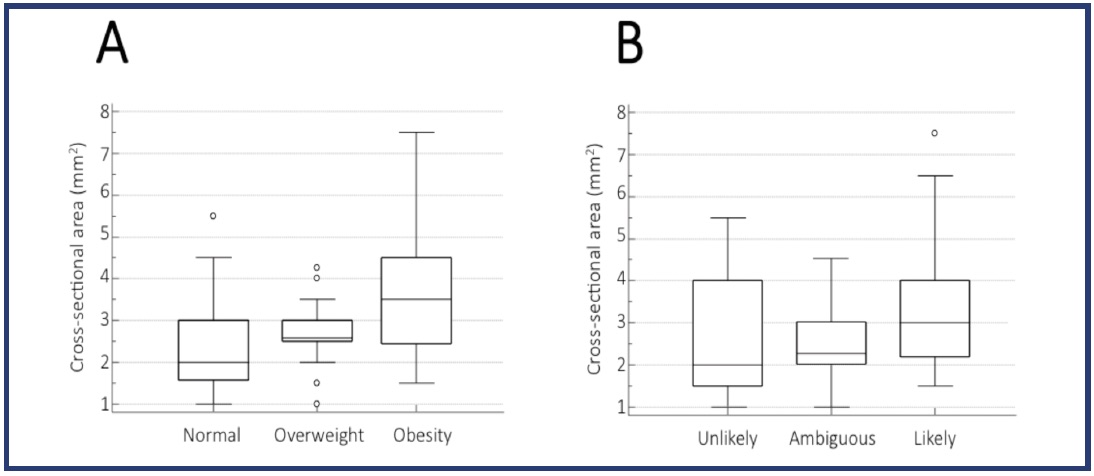
Figura 2. Differrenze del CSA del nervo surale per le categorie bMI ePDQ. Diagrammi box-and-whisker che mostrano le differenze del CSA del nervo surale tra le categorie BMI (A) e PDQ (B) misurate mediante analisi unidirezionale della varianza (ANOVA).
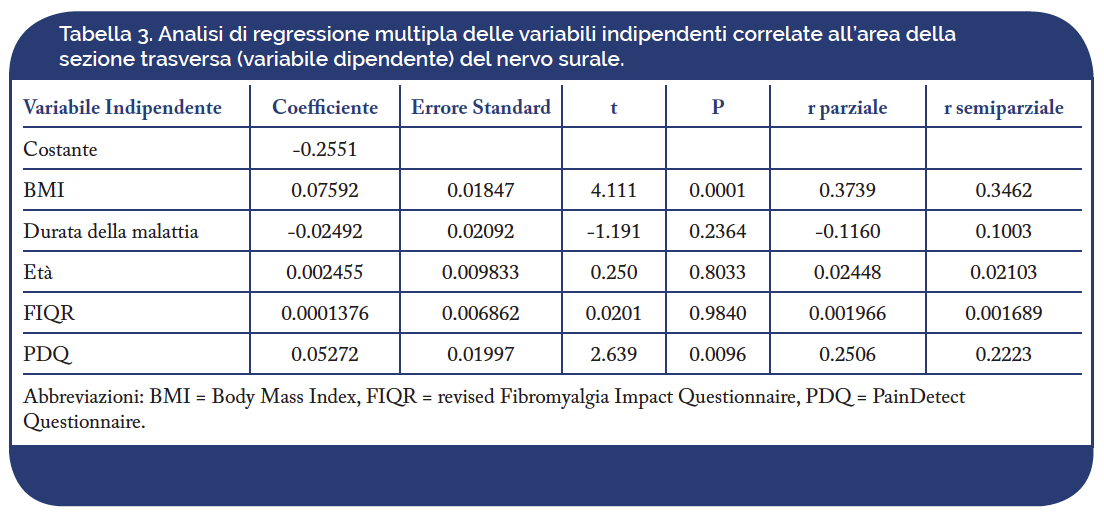
L’analisi di regressione multipla ha confermato che le uniche due variabili indipendenti significativamente associate alla CSA del nervo surale erano il BMI (p = 0,0001) e il PDQ (p = 0,0096), mentre l’età del paziente, la durata della malattia e persino il punteggio FIQ-R non mostravano alcuna associazione (Tabella 3).
L’ICC è stato calcolato su 26 pazienti valutati da entrambi gli ecografisti. L’accordo inter-reader era eccellente sia per la circonferenza (ICC = 0,97, intervallo di confidenza del 95% 0,94-0,98) sia per la misurazione CSA del nervo surale (ICC = 0,96, intervallo di confidenza del 95% 0,92-0,98).
Discussione
In questo studio è stato dimostrato che attraverso metodi non invasivi e facilmente utilizzabili come la MNUS sia possibile indagare su un potenziale coinvolgimento del SNP in pazienti con FM. Per quanto si sa, questo è il primo studio che ha valutato la dimensione del nervo surale utilizzando la NMUS in pazienti con FM, dimostrando una correlazione tra la CSA (e la circonferenza del nervo) con il BMI e con le caratteristiche del dolore neuropatico. È risaputo che nei nervi periferici si può riscontrare una CSA aumentata nel sito di neuropatie compressive o in caso di polineuropatie con diverse eziologie (5). Tuttavia, alcuni lavori suggeriscono che la dimensione di alcuni nervi può essere un’espressione di ciò che accade alle piccole fibre nervose. Nella lorointeressante pubblicazione del 2015, Ebadi e colleghi hanno dimostrato che la CSA del nervo surale risulta essere aumentata durante la SFN, utilizzando come tecnica sempre la NMUS e confrontandolo con la CSA di soggetti sani. Il meccanismo fisiopatologico di come una SFN possa indurre cambiamenti morfologici nel nervo surale deve essere chiarito, ma si suppone che una CSA aumentata sia un’espressione di alterazioni del flusso assoplasmatico che coinvolgono le piccole fibre A delta e C (4). Nei pazienti FM, si presume che un aumento della CSA del nervo surale possa essere un’espressione di SFN.
La patogenesi della FM è un argomento di ricerca di lunga data, e lo studio delle piccole fibre nervose è una recente area di interesse. Giannoccaro e colleghi per la prima volta nel 2014 hanno introdotto la biopsia cutanea nei pazienti FM, rivelando la presenza di SFN in 6 dei 20 pazienti studiati (1). Da allora sono stati svolti diversi studi, fino a una recente meta-analisi che documenta la presenza di una SFN in circa la metà dei pazienti con FM (2).
Nel presente studio abbiamo considerato la CSA del nervo surale come surrogato della SFN, rivelando la sua stretta associazione con il BMI. L’associazione tra SFN e obesità è stata riconosciuta oltre 10 anni fa. È stato dimostrato, infatti, come una SFN possa essere una manifestazione precoce dell’alterata tolleranza glucidica, del diabete mellito, e dell’insulino resistenza nei pazienti obesi. Summer e colleghi hanno dimostrato che le piccole fibre nervose risultano essere notevolmente compromesse in soggetti con alterata tolleranza al glucosio, e che addirittura sono il primo segno rilevabile nell‘insorgenza di una neuropatia in persone con dismetabolismo al glucosio e con insulino resistenza.
Studi bioptici hanno dimostrato come, in questi casi, avvenga prima il coinvolgimento delle piccole fibre che delle grandi fibre (10). I meccanismi coinvolti nel danno alle piccole fibre nervose nei soggetti obesi sembrano essere attribuibili anche all’eccessiva produzione di ossidanti. Lo stress ossidativo può essere, infatti, una conseguenza, ma anche una causa dell’obesità. Inoltre, l’obesità comporterebbe anche l’insorgenza di difetti neurovascolari, portando ad un’ipossia endoneuronale, danneggiando il nervo. Lo stress ossidativo agirebbe contro le piccole fibre sia direttamente, sia indirettamente danneggiano la trama vascolare (11). Anche il legame tra obesità e FM è noto da anni, sebbene la relazione causa-effetto non sia stata ancora chiarita (12). Diversi studi, infatti, hanno evidenziato una stretta correlazione: circa il 40% di pazienti FM è obeso, e il 30% in sovrappeso. L’obesità sembrerebbe peggiorare il quadro clinico FM incidendo negativamente sulla progressione della malattia, riducendo le funzioni fisiche, aumentando lo stress, la rigidità, l’affaticamento e riducendo la qualità della vita. Inoltre, circa il 75% dei pazienti con FM ha un cambiamento nella composizione corporea che li porta ad avere più massa grassa, aumentando la produzione di mediatori infiammatori, con conseguente aumento della percezione di sintomi dolorosi (13) (14) (15). Nel nostro studio questa correlazione è stata dimostrata, in quanto meno del 40% dei pazienti FM avevano un BMI nella norma. Probabilmente, una parte significativa di questa sensibilizzazione dipende dal danno alle piccole fibre nervose. La dimensione dei nervi periferici può anche essere influenzata da altre variabili, una delle quali è l’età. Da un precedente lavoro di Cartwright e colleghi è emerso come la dimensione del nervo tende ad aumentare in relazione all’età (16). Tuttavia, un recente studio di Druzhinin e colleghi smentisce questo, dimostrando come la variazione delle dimensioni in relazione all’età sia riscontrabile solo nei bambini e adolescenti fino all’età di 12-14 anni, dopodiché tende a stabilizzarsi nel corso dell’età adulta (17). Nel nostro studio, in accordo con quest’ultimo lavoro, tale correlazione non è emersa, e probabilmente a causa del fatto che la dimensione del nervo surale è influenzata meno degli altri nervi dall’età (17). La correlazione tra la CSA del nervo surale e PDQ può essere intuitiva e prevedibile. Il fatto che un’espressione US di danno al SNP sia correlata al punteggio PDQ, rende ragione dell’utilizzo del questionario nella valutazione dei pazienti FM. L’uso di questionari volti a studiare la presenza di caratteristiche del dolore neuropatico è stato criticato nei pazienti con FM perché si ritiene che i punteggi più alti dipendano da un controllo del dolore centrale alterato (18).
Nel nostro studio abbiamo dimostrato come i dati di un questionario riportato dal paziente, indagando la presenza di componenti neuropatiche del dolore, siano effettivamente correlati alle misurazioni NMUS. Questo fatto può confermare che l’uso del PDQ rimane valido, specialmente in una categoria di pazienti affetti da FM in sovrappeso o obesi.
La mancanza di associazione con i parametri che identificano l’attività della malattia (cioè FIQ-R) ci porta ad affermare che la CSA del nervo surale non è un’espressione della gravità della malattia ma, piuttosto, può identificare una categoria di pazienti con maggiore coinvolgimento del SNP. Infine, abbiamo dimostrato che i medici con esperienza di US muscolo-scheletrica possono, con una breve formazione, anche imparare a eseguire la NMUS del nervo surale in modo estremamente affidabile.
Il principale limite dello studio è rappresentato dal fatto che in questa coorte di pazienti non è stato eseguito l’esame istologico sulla biopsia cutanea, il test diagnostico considerato il gold standard per documentare la presenza di SFN. In una ricerca futura sarà certamente necessario valutare la correlazione tra diagnosi istologica e NMUS anche nei pazienti FM. Un’altra potenziale limitazione è il reclutamento in un singolo centro. Tuttavia, l’esame NMUS del nervo surale è stato eseguito da due operatori indipendenti, dimostrando che, dopo un breve periodo di formazione, è possibile raggiungere un accordo eccellente utilizzando macchine diverse.
In conclusione, da questo studio emerge come sia possibile identificare una sottopopolazione di pazienti FM. Infatti, andando ad effettuare le misurazioni della CSA del nervo surale tramite un esame di semplice utilizzo, rapido e non invasivo come la NMUS, si nota come ci sia una stretta correlazione tra la CSA stesso e i pazienti con positività alla sintomatologia tipica del dolore neuropatico, valutabile tramite il PDQ, e anche con i pazienti in sovrappeso e obesi. Il PDQ assumerebbe, quindi, una valenza importante nel percorso diagnostico della FM. Per quanto riguarda il questionario FIQ-R, non essendo stata trovata una stretta associazione tra esso e la CSA del nervo surale, questo ci porta a pensare che suddette misurazioni NMUS ci permettono di inquadrare non tanto la gravità della FM stessa, quanto una sottocategoria di pazienti. La conferma dei risultati di questo studio dovrebbe essere ottenuta in studi futuri in cui i dati dell’esame NMUS possono essere integrati con i risultati istologici.
Punti chiave
- L’ecografia è una metodica di imaging sempre più utilizzata nello studio del sistema nervo periferico, anche in corso di malattie reumatiche.
- Nei pazienti affetti da neuropatia delle piccole fibre, è stata dimostrata una correlazione tre il quadro istologico, indicativo di neuropatia, ed un’aumentata area trasversa del nervo surale, misurata ecograficamente a livello della porzione distale della gamba.
- Una neuropatia delle piccole fibre è documentabile in circa la metà dei pazienti affetti da fibromialgia.
- Un’aumentata area trasversa del nervo surale nei pazienti affetti da fibromialgia è associata, in maniera statisticamente significativa, con l’indice di massa corporea e con le caratteristiche neuropatiche della sintomatologia dolorosa.
- L’area trasversa del nervo surale, misurata ecograficamente a livello della porzione distale della gamba, potrebbe rappresentare un rilievo imaging indicativo di un coinvolgimento del sistema nervoso periferico in pazienti affetti da fibromialgia.
Bibliografia
- Giannoccaro MP, Donadio V, Incensi A, Avoni P, Liguori R. Small nerve fiber involvement in patients referred for fibromyalgia. Muscle Nerve;49:757-759. 2014.
- Grayston R, Czanner G, Elhadd K, Goebel A, Frank B, Üçeyler N, et al. A systematic review and meta-analysis of the prevalence of small fiber pathology in fibromyalgia: Implications for a new paradigm in fibromyalgia etiopathogenesis. Semin Arthritis Rheum. 2019.
- K., Farhad. Current Diagnosis and Treatment of Painful Small Fiber Neuropathy. Curr Neurol Neurosci Rep;19:103. 2019.
- Ebadi H, Siddiqui H, Ebadi S, Ngo M, Breiner A, Bril V. Peripheral Nerve Ultrasound in Small Fiber Polyneuropathy. Ultrasound Med Biol; 41:2820-2826. 2015.
- Bianchi S, Droz L, Lups Deplaine C, Dubois-Ferriere V, Delmi M. Ultrasonography of the Sural Nerve: Normal and Pathologic Appearances. J Ultrasound Med;37:1257-1265. 2018.
- LD., Hobson-Webb. Emerging Technologies in Neuromuscular Ultrasound. Muscle Nerve 2020. Published online: February 3. DOI: 10.1002/mus.26819. 2020.
- Wolfe F, Anderson J, Harkness D, et al. Health status and disease severity in fibromyalgia: results of a six-center longitudinal study. Arthritis & . 1997.
- Simonetti S, Bianchi S, Martinoli C. Neurophysiological and ultrasound findings in sural nerve lesions following stripping of the small saphenous vein. Muscle Nerve;22:1724-1726. 1999.
- Goedee HS, van der Pol WL, van Asseldonk JH, Vrancken AFJE, Notermans NC, Visser LH, et al. Nerve sonography to detect peripheral nerve involvement in vasculitis syndromes. Neurol Clin Pract;6:293-303. 2016.
- Sumner C, Sheth S, Griffin J, Cornblath D, Polydefkis M. The spectrum of neuropathy in diabetes and impaired glucose tolerance. Neurology; 60: 108–111. 2003.
- Cameron, N. E., Cotter, M. A., Archibald, V., Dines, K. C., & Maxfield, E. K. Anti-oxidant and pro-oxidant effects on nerve conduction velocity, endoneurial blood flow and oxygen tension in non-diabetic and streptozotocindiabetic rats. Diabetologia, 37(5), 449–459. doi:10.1007/ s001250050131 .
- Ursini F, Naty S, Grembiale RD. Fibromyalgia and obesity: the hidden link. Rheumatol Int;31:1403-1408. . 2011.
- Aparicio VA, Ortega FB, Carbonell-Baeza A, Gatto-Cardia C, Sjöström M, Ruiz JR, et al. Fibromyalgia’s key symptoms in normal-weight,overweight, and obese female patients. Pain Manag Nurs;14:268-276. 2013.
- Rossi A, Di Lollo AC, Guzzo MP, Giacomelli C, Atzeni F, Bazzichi L, et al. Fibromyalgia and nutrition: what news? Clin Exp Rheumatol;33(1 Suppl 88):S117-S125. 2015.
- Salaffi F, Giacobazzi G, Di Carlo M. Chronic Pain in Inflammatory Arthritis: Mechanisms, Metrology, and Emerging Targets-A Focus on the JAK-STAT Pathway. Pain Res Manag;2018:8564215. 2018.
- Cartwright MS, Mayans DR, Gillson NA, Griffin LP, Walker FO. Nerve cross-sectional area in extremes of age. Muscle Nerve;47:890-893. 2013.
- Druzhinin D, Naumova Е, Nikitin S. Nerve ultrasound normal values in children and young adults. Muscle Nerve;60:757-761. . 2019.
- Gauffin J, Hankama T, Kautiainen H, Hannonen P, Haanpää M. Neuropathic pain and use of PainDETECT in patients with fibromyalgia: a cohort study. BMC Neurol; 13:21. 2013
- Giorli, T. Bocci, A. Di Rollo, D. Barloscio, L. Parenti, M. Bartolotta, M. Santin. Medicina Clinica e Sperimentale, Neurofisiopatologia – DAI Neuroscienze AOUP F.
- Salaffi F, Di Carlo M, Arcà S, Galeazzi M. Categorisation of disease severity states in fibromyalgia: a first step to support decision-making in health care policy. Clin Exp Rheumatol; 36:1074-1081. 2018.
- Di Carlo M, Muto P, Benfaremo D, Luchetti MM, Atzeni F, Salaffi F. The neuropathic pain features in Psoriatic Arthritis: a cross-sectional evaluation of prevalence and associated factors. J Rheumatol 2019. Published online: DOI: 10.3899/jrheum.190906. 2019.
- Freynhagen R, Tölle TR, Gockel U, Baron R. The painDETECT project – far more than a screening tool on neuropathic pain. Curr Med Res Opin;32:1033-1057. 2016.
- C., Sommer. Nerve and skin biopsy in neuropathies. Curr Opin Neurol;31:534-540. 2018.
- Herman RM, Brower JB, Stoddard DG, Casano AR, Targovnik JH, Herman JH, et al. Prevalence of somatic small fiber neuropathy in obesity. Int J Obes (Lond);31:226-235. 2007.
- Werner RA, Jacobson JA, Jamadar DA. Influence of body mass index on median nerve function, carpal canal pressure, and cross-sectional area of the median nerve. Muscle Nerve;30:481-485. 2004.
- Lothet EH, Bishop TJ, Walker FO, Cartwright MS. Ultrasound- Derived Nerve Cross-Sectional Area in Extremes of Height and Weight. J Neuroimaging;29:406-409. 2019.
- Higuchi M, Dusting GJ, Peshavariya H, et al. Differentiation of human adipose-derived stem cells into fat involves reactive oxygen species and forkhead box O1 mediated upregulation of antioxidant enzymes. Stem Cells Dev;22:878–88. 2013.
- Oudejans L, He X, Niesters M, Dahan A, Brines M, van Velzen M. Cornea nerve fiber quantification and construction of phenotypes in patients with fibromyalgia. Sci Rep;6:23573. 2016.
