L’ECOGRAFIA NELLE ARTROPATIE MICROCRISTALLINE
AUTORI:
Edoardo Cipolletta1, Emilio Filippucci1
1Clinica Reumatologica, Dipartimento Scienze Cliniche e Molecolari DISCLIMO, Università Politecnica delle Marche, Jesi (AN)
Introduzione
Le artropatie microcristalline sono caratterizzate dalla deposizione di cristalli a livello dei tessuti articolari e periarticolari. Tra i principali tipi di cristalli responsabili di patologia nell’essere umano figurano: i cristalli di urato monosodico (MSU), quelli di pirofosfato diidrato di calcio (CPP) e quelli di idrossiapatite (BCP).
L’ecografia muscoloscheletrica ha dimostrato di essere una metodica di imaging essenziale nell’iter diagnostico delle artropatie da cristalli (Stewart S, et al. Semin Arthritis Rheum. 2021; Cipolletta E, et al. Osteoarthritis Cartilage. 2021). L’elevato potere di risoluzione spaziale, l’assenza di radiazioni ionizzanti, i bassi costi operativi, l’elevata tollerabilità da parte del paziente e la rapidità di esecuzione rappresentano i principali vantaggi rispetto ad altre metodiche strumentali.
Il potenziale diagnostico dell’ecografia nelle artropatie microcristalline risiede nella possibilità di condurre un esame multi-distrettuale e multi-tissutale, nell’elevato potere di risoluzione spaziale delle sonde lineari di ultima generazione, nella capacità di effettuare una valutazione dinamica ed in tempo reale e in quella di poter guidare l’aspirazione di anche minime quantità di liquido sinoviale ma comunque sufficienti per confermare l’identificazione dei microcristalli con esame al microscopio ottico (Grassi W, et al. Curr Opin Rheumatol. 2015 ). Inoltre, l’elevata riflettività dei depositi cristallini agevola l’identificazione ecografica di tali depositi anche se di piccole dimensioni. Infine, la dimostrazione che la formazione dei depositi cristallini precede la comparsa di manifestazioni cliniche rende l’ecografia particolarmente utile anche nelle prime fasi di malattia.
Nel corso degli ultimi decenni la letteratura scientifica si è arricchita di numerosi contributi che hanno descritto in modo dettagliato la semeiotica ecografica nella gotta e nella malattia da deposito di pirofosfato di calcio (CPPD) e dimostrato la ottima accuratezza diagnostica dell’ecografia nella diagnosi delle artropatie cristalline. I più recenti criteri classificativi American College of Rheumatology (ACR)/European League Against Rheumatism (EULAR) per la diagnosi di gotta hanno incluso il segno ecografico del “doppio contorno” tra i rilievi imaging, mentre l’elevata sensibilità e specificità dell’ecografia musculoscheletrica nella diagnosi di CPPD è stata sottolineata nelle ultime raccomandazioni EULAR (Neogi T, et al. Ann Rheum Dis. 2015; Zhang W, et al. Ann Rheum Dis 2011).
In ecografia, i depositi microcristallini presentano alcune caratteristiche comuni: fra queste figurano la loro elevata riflettività e la capacità di generare echi in modo indipendente dall’angolo di incidenza del fascio ultrasonoro. Altre caratteristiche consentono di differenziarli: la dimensione (da spot millimetrici a depositi molto grandi), forma (rotondeggianti, allungati o irregolari), l’ecostruttura (omogenei o disomogenei) e la distribuzione topografica dei loro depositi (Filippucci E, et al. Rheumatology (Oxford). 2012). Quest’ultima caratteristica è il principale parametro che consente di distinguere, ad esempio, i depositi cartilaginei di CPP da quelli di MSU. Infatti, mentre i primi si localizzano all’interno delle strutture cartilaginee, i cristalli di MSU si depositano sulla superficie della cartilagine ialina. Un altro utile parametro è la presenza di ombra acustica posteriore, caratteristica di frequente riscontro in presenza di depositi di MSU e di idrossiapatite, ma non di quelli di CPP (Filippou G, et al. Ann Rheum Dis. 2022).
GOTTA
I rilievi ecografici nella gotta includono segni aspecifici come il versamento intra-articolare, l’ipertrofia sinoviale, le erosioni ossee e quelli specifici dovuti alla presenza di depositi di MSU a livello dei tessuti molli articolari e periarticolari (Terslev L, et al. J Rheumatol. 2015; Christiansen SN, et al. Semin Arthritis Rheum. 2021). L’artrite acuta gottosa è tipicamente caratterizzata dalla presenza di una distensione della capsula articolare per la presenza di una quota variabile di liquido sinoviale. In alcuni casi è possibile evidenziare la presenza di un aspetto a tempesta di neve che deriva dalla presenza di spot iperecogeni che fluttuano all’interno del liquido sinoviale.
La sinovite nella gotta appare come una distensione della capsula con spazio articolare di aspetto eterogeneo ma prevalentemente iperecogeno per la presenza di tofi intra-articolari di varie dimensioni ed ecostruttura associati o meno con aree di ipertrofia sinoviale. La presenza degli spot iperecogeni può essere utile per differenziare la gotta da altre artropatie infiammatorie come l’artrite reumatoide (Figura 1).
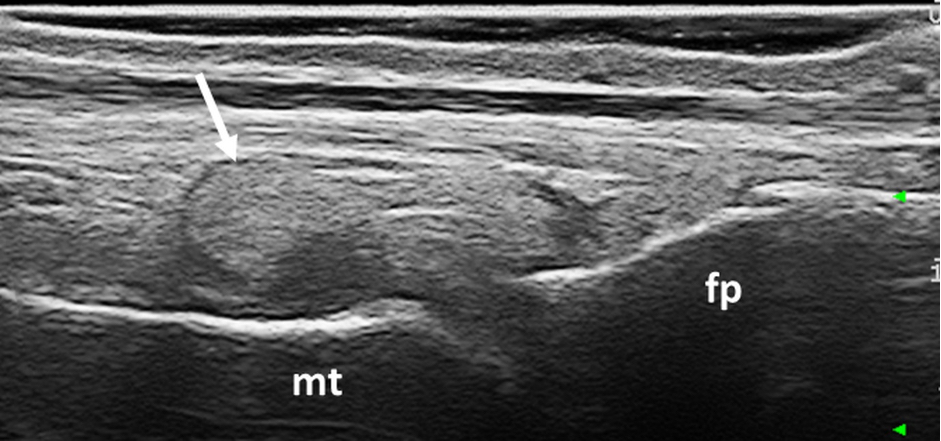 Figura 1. Gotta. Deposito tofaceo intrarticolare (frecce) a livello della articolazione metatarsofalangea del I dito del piede. Immagine acquisita in scansione longitudinale dorsale. fp= falange prossimale, mt = metatarso.
Figura 1. Gotta. Deposito tofaceo intrarticolare (frecce) a livello della articolazione metatarsofalangea del I dito del piede. Immagine acquisita in scansione longitudinale dorsale. fp= falange prossimale, mt = metatarso.
La prevalenza delle erosioni ossee in pazienti con artropatia gottosa appare associata con la durata di malattia. Le erosioni ossee nella gotta sono in genere localizzate in prossimità dei tofi. I margini “sovrastanti” e la presenza di depositi iperecogeni che riempiono la cavità erosiva sono elementi caratteristici della gotta. Un ulteriore aspetto peculiare delle erosioni ossee nella gotta è che queste possono essere sia intra- che extra-articolari.
In accordo con le ultime definizioni OMERACT (Terslev L, et al. J Rheumatol. 2015; Christiansen SN, et al. Semin Arthritis Rheum. 2021), i depositi di MSU possono essere definiti come indicato nella Tabella 1.

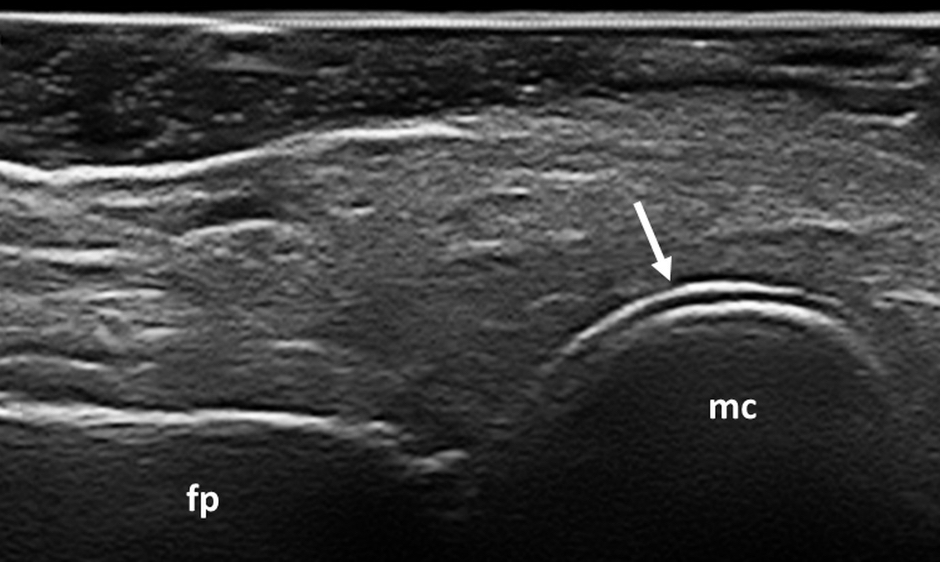 Figura 2. Gotta. Segno del doppio contorno (freccia) a livello dell’articolazione metacarpofalangea del II dito della mano. Immagine acquisita in scansione longitudinale dorsale. fp: falange prossimale, mc: metacarpo.
Figura 2. Gotta. Segno del doppio contorno (freccia) a livello dell’articolazione metacarpofalangea del II dito della mano. Immagine acquisita in scansione longitudinale dorsale. fp: falange prossimale, mc: metacarpo.
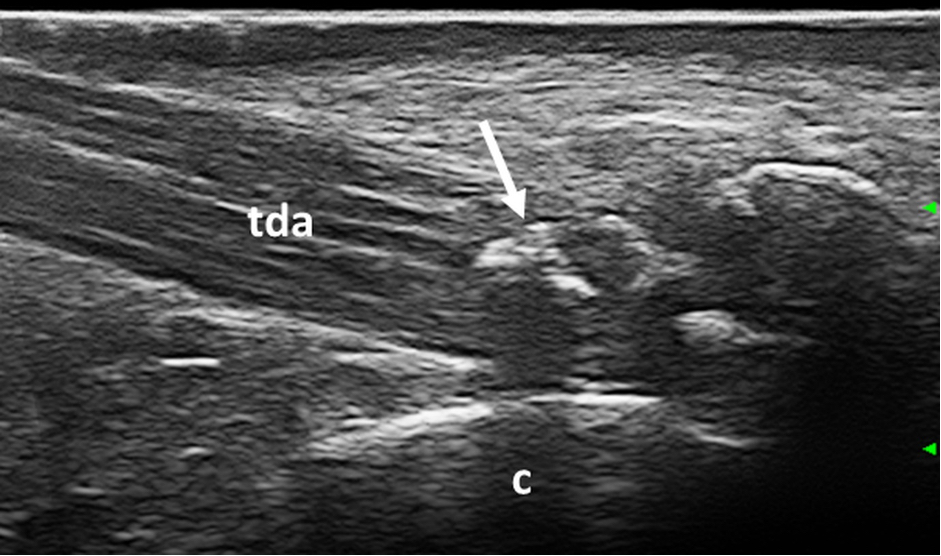 Figura 3. Gotta. Aggregato intra-tendineo (freccia) caratterizzato da ombra acustica posteriore a livello del tendine di Achille. Immagine acquisita in scansione longitudinale. tda: tendine di achille, c: calcagno.
Figura 3. Gotta. Aggregato intra-tendineo (freccia) caratterizzato da ombra acustica posteriore a livello del tendine di Achille. Immagine acquisita in scansione longitudinale. tda: tendine di achille, c: calcagno.
 Figura 4. Gotta. Depositi tofacei (frecce) a livello dell’inserzione distale del tendine patellare (figura superiore) e a livello dell’articolazione metatarsofalangea del I dito del piede (figura inferiore). Immagini acquisite in scansione longitudinale. fp: falange prossimale, mt: metatarso, tp: tendine patellare, t: tibia.
Figura 4. Gotta. Depositi tofacei (frecce) a livello dell’inserzione distale del tendine patellare (figura superiore) e a livello dell’articolazione metatarsofalangea del I dito del piede (figura inferiore). Immagini acquisite in scansione longitudinale. fp: falange prossimale, mt: metatarso, tp: tendine patellare, t: tibia.
L’identificazione ecografica dei depositi di MSU a livello tendineo è facilitata dal fatto che è possibile sfruttare le proprietà di anisotropia dei tendini. Infatti, i depositi tendinei mantengono la loro iperecogenicità quando il tendine non è insonato perpendicolarmente (Figura 5) (Grassi W, et al. Curr Opin Rheumatol. 2015; Filippucci E, et al. Rheumatology (Oxford). 2012).
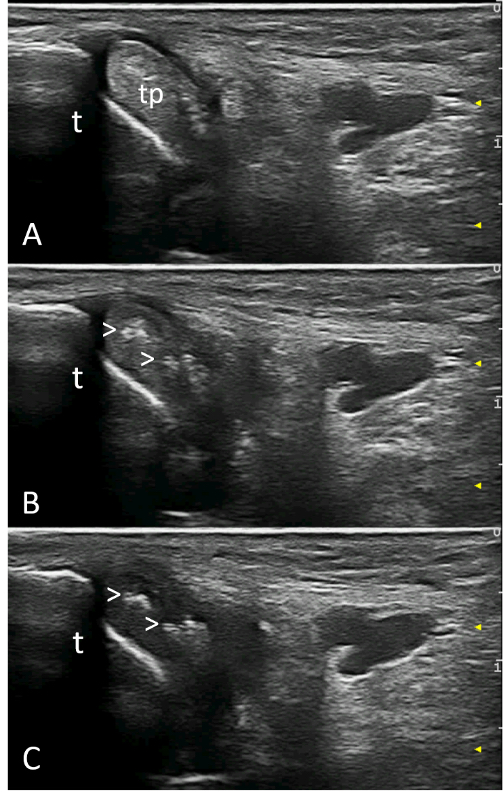 Figura 5. Gotta. Depositi microcristallini (teste di freccia) nel contesto del tendine del tibiale posteriore. Immagini acquisite in scansione trasversale con diversa inclinazione della sonda e conseguente diverso angolo di incidenza del fascio ultrasonoro. Mentre si riduce la ecogenicità delle fibrille tendinee, i depositi microcristallini mantengono invariata la loro iperecogenicità. t = tibia; tp= tendine del tibiale posteriore.
Figura 5. Gotta. Depositi microcristallini (teste di freccia) nel contesto del tendine del tibiale posteriore. Immagini acquisite in scansione trasversale con diversa inclinazione della sonda e conseguente diverso angolo di incidenza del fascio ultrasonoro. Mentre si riduce la ecogenicità delle fibrille tendinee, i depositi microcristallini mantengono invariata la loro iperecogenicità. t = tibia; tp= tendine del tibiale posteriore.
La gotta è una malattia sistemica che può potenzialmente interessare ogni distretto corporeo. Tuttavia, nella pratica clinica quotidiana, l’esame ecografico deve essere ottimizzato al fine di incrementarne la fattibilità senza una significativa riduzione in termini di accuratezza diagnostica. Innanzitutto, la valutazione ecografica deve essere guidata dalla anamnesi del paziente e dall’esame obiettivo, che saranno volti a identificare sedi sintomatiche o che lo sono state in passato. L’ecografia dovrà inoltre valutare le sedi più frequentemente interessate dalla deposizione di cristalli di MSU. In ambito reumatologico, sono stati proposti diversi protocolli ecografici (Tabella 2).
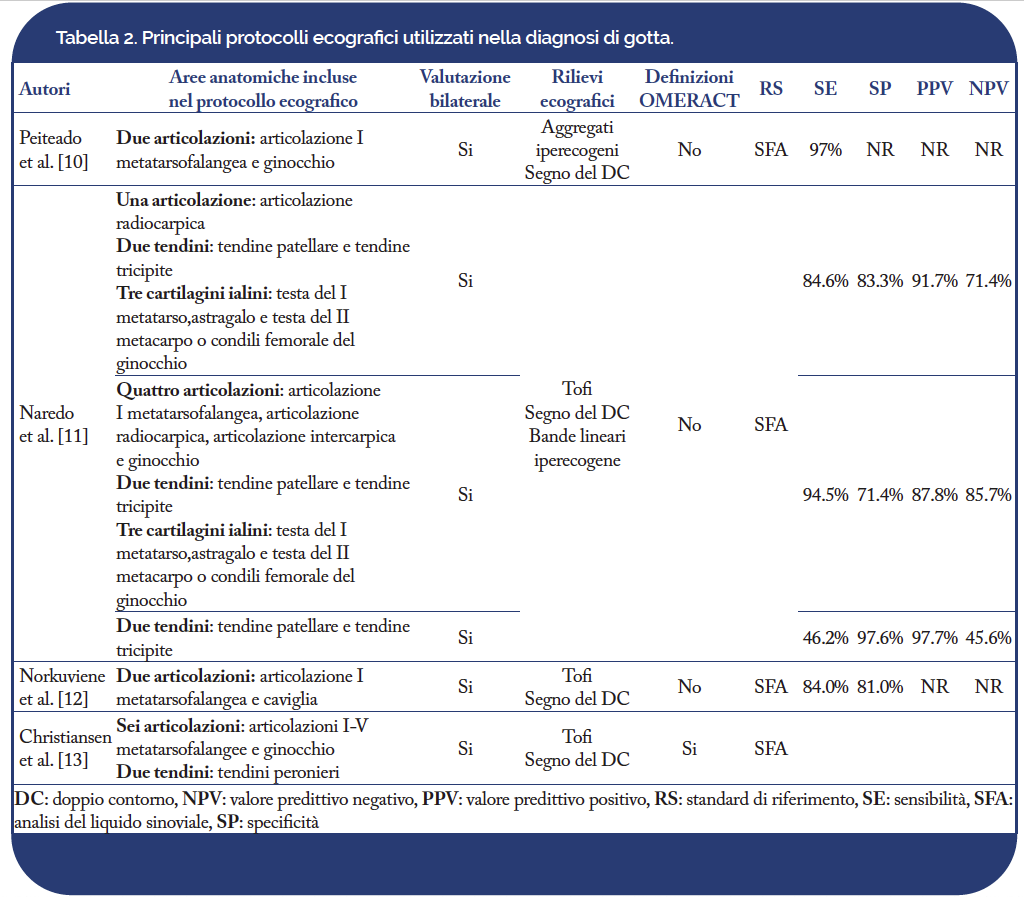
Nel 2014, un gruppo di studio spagnolo ha proposto un protocollo ecografico volto alla diagnosi di gotta in soggetti in fase inter-critica che comprende la valutazione bilaterale di una articolazione (l’articolazione radiocarpica per gli aggregati/tofi), due tendini (tendine patellare e tricipite per gli aggregati/tofi) e tre cartilagini articolari (articolazione metatarsofalangea del I dito, caviglia e ginocchio) con sensibilità dell’85% e specificità dell’83% (Naredo E, et al. Ann Rheum Dis. 2014).
Più recentemente, il nostro gruppo di ricerca ha proposto un protocollo ecografico per la diagnosi di gotta nel paziente con mono-oligoartrite acuta. In tale scenario clinico, l’inclusione dell’articolazione sede del processo sinovitico è stata aggiunta alla valutazione bilaterale di ginocchio e articolazione metatarsofalangea del I dito; così facendo è stato possibile ottenere valori di accuratezza diagnostica di circa il 90% (Cipolletta E, et al. Annals of the Rheumatic Diseases 2020).
Infine, la valutazione bilaterale della articolazione metatarsofalangea del I dito (per tofi e segno del doppio contorno) e del ginocchio (per il segno del doppio contorno) ha mostrato la miglior accuratezza nel distinguere i soggetti con iperuricemia asintomatica da quelli normouricemici (Stewart S, et al. Semin Arthritis Rheum. 2019).
L’ecografia ha mostrato di essere un utile strumento non solo nella diagnosi di gotta, ma anche nel follow-up dei rilievi dovuti alla presenza di depositi di MSU.
È stato, infatti, dimostrato che l’ecografia è in grado di monitorare la dissoluzione dei depositi di MSU durante la terapia ipouricemizzante. In tal senso, un interessante protocollo, volto a valutare la risposta alla terapia ipouricemizzante, è stato proposto nel 2022 da un gruppo danese; tale protocollo comprende lo studio bilaterale della articolazione metatarsofalangea del I e del II dito, i tendini dei peronieri, il tendine patellare ed il ginocchio (Christiansen SN, et al. Rheumatology (Oxford) 2022) .
Al fine di facilitare il monitoraggio della risposta terapeutica, l’OMERACT ha proposto uno score semiquantitativo per i rilievi ecografici indicativi di depositi di MSU come segue: 0, assenza di depositi; 1, deposito possibile; 2, deposito certo ma di minima entità; 3, deposito certo e di entità significativa (Christiansen SN, et al. Semin Arthritis Rheum. 2021).
La valutazione ecografica della estensione dei depositi di MSU e della flogosi subclinica ha mostrato anche di essere in grado di predire il rischio di “flare” nei successivi 12 mesi. La stima dell’entità dei depositi ha inoltre dimostrato di poter predire la possibilità di raggiungere uno stato di remissione entro 12 mesi (Cipolletta E, et al. Arthritis Res Ther. 2021; Uhlig T, et al. Arthritis Res Ther. 2022).
CPPD
Sebbene i principali bersagli della CPPD siano le strutture cartilaginee (fibrocartilagini e cartilagini ialine), i cristalli di CPP possono depositarsi anche a livello tendineo, capsulare e legamentoso.
La CPPD può interessare qualsiasi articolazione sinoviale o fibrocartilaginea, tuttavia, le ginocchia, i polsi, le anche, le spalle e la sinfisi pubica sono i bersagli più frequenti.
All’ecografia, i cristalli di CPP appaiono come spot iperecogeni, isolati o aggregati, tipicamente senza ombra acustica posteriore, generalmente localizzati all’interno delle strutture cartilaginee (Filippou G, et al. J Rheumatol. 2017; Filippou G, et al. Ann Rheum Dis. 2018 ).
La Tabella 3 riporta le definizioni OMERACT dei rilievi ecografici indicativi di depositi di CPP(Filippou G, et al. J Rheumatol. 2017; Filippou G, et al. Ann Rheum Dis. 2018 ).
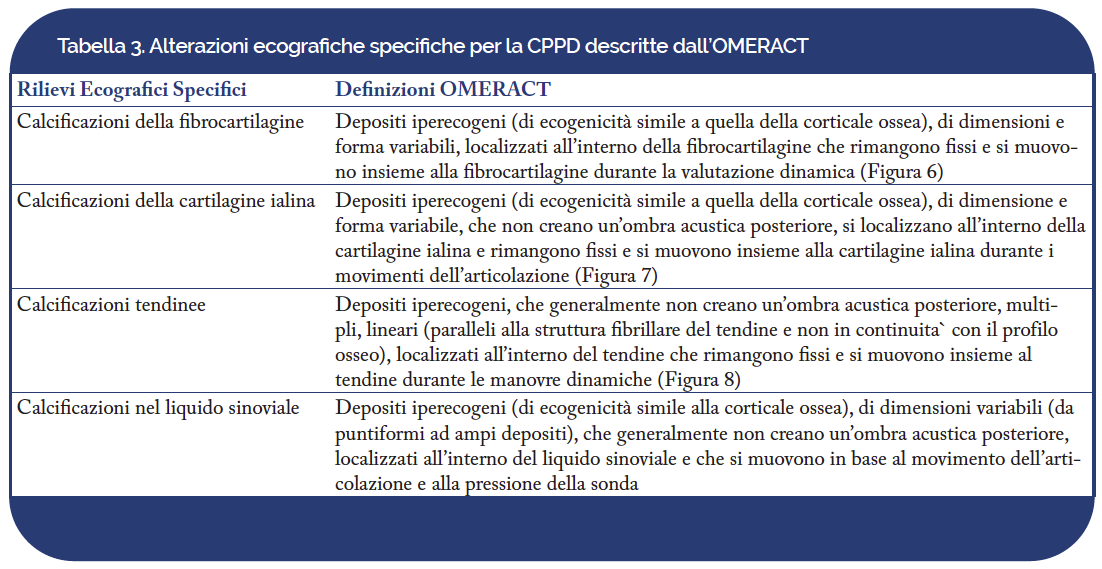
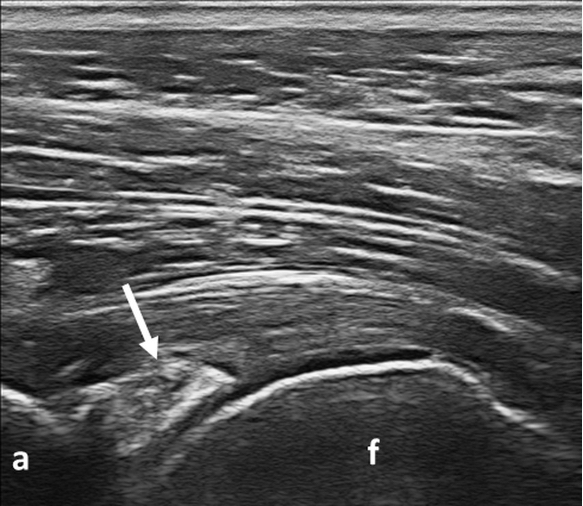 Figura 6. CPPD. Calcificazione fibrocartilaginea (freccia) a livello dell’acetabolo. Immagine acquisita in scansione longitudinale. a: acetabolo; f: femore.
Figura 6. CPPD. Calcificazione fibrocartilaginea (freccia) a livello dell’acetabolo. Immagine acquisita in scansione longitudinale. a: acetabolo; f: femore.
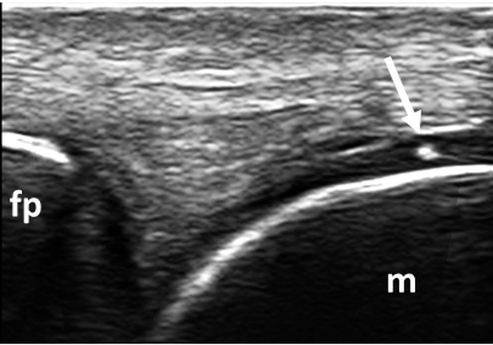 Figura 7. CPPD. Calcificazione ialina (freccia) a livello della cartilagine ialina della testa metacarpale del II dito della mano. Immagine acquisita in scansione longitudinale dorsale. fp: falange prossimale, m: metacarpo.
Figura 7. CPPD. Calcificazione ialina (freccia) a livello della cartilagine ialina della testa metacarpale del II dito della mano. Immagine acquisita in scansione longitudinale dorsale. fp: falange prossimale, m: metacarpo.
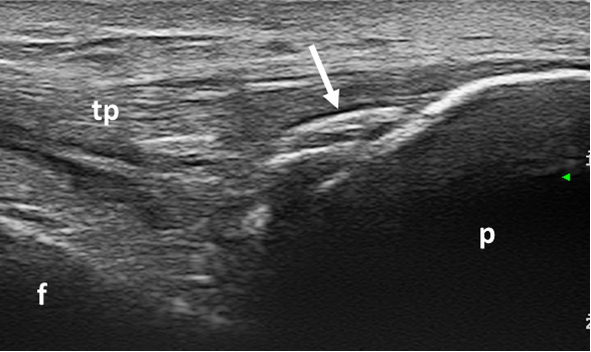 Figura 8. CPPD. Calcificazioni intra-tendinee (freccia) a livello dell’inserzione distale del tendine patellare a livello della patella. Immagine acquisita in scansione longitudinale. f: femore, p: patella, tp: tendine patellare.
Figura 8. CPPD. Calcificazioni intra-tendinee (freccia) a livello dell’inserzione distale del tendine patellare a livello della patella. Immagine acquisita in scansione longitudinale. f: femore, p: patella, tp: tendine patellare.
Sebbene i cristalli di CPP siano facilmente identificabili sulla base delle loro caratteristiche ecografiche, essi devono essere distinti da altri rilievi ecografici caratterizzati da un aspetto iperecogeno come piccoli aggregati di MSU o BCP, detriti osteocondrali, bolle d’aria e depositi fibrinoidi localizzati dentro o intorno all’articolazione (Filippucci E, et al. Rheumatology (Oxford). 2012).
Caratteristicamente, i depositi di CPP mantengono la loro iperecogenicità nonostante un cambiamento dell’angolo di incidenza del fascio ultrasonoro o la riduzione dei livelli di guadagno(Filippucci E, et al. Rheumatology (Oxford). 2012). Inoltre, la valutazione dinamica può risultare determinante nel definire l’esatta sede di deposizione dei cristalli di CPP (ad esempio, nella distinzione tra calcificazioni capsulari e cartilaginee) (Cipolletta E, et al. Rheumatology (Oxford). 2022).
In aggiunta ai rilievi ecografici indicativi di depositi di CPP, la CPPD si caratterizza per la coesistente presenza di manifestazioni simil-osteoartrosiche (Figura 9).
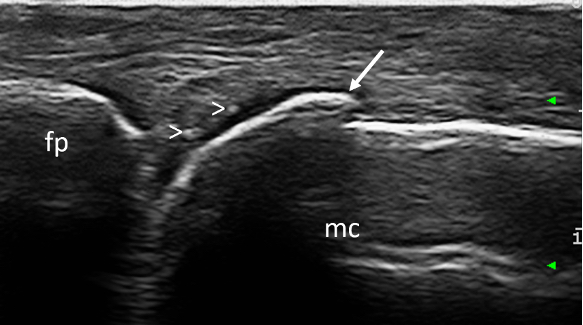 Figura 9. CPPD. Depositi microcristallini (teste di freccia) nel contesto dello strato cartilagineo di una testa metacarpale. Immagine acquisita in scansione longitudinale dorsale di una articolazione metacarpofalangea. fp = falange prossimale; mc = metacarpo; freccia= osteofita.
Figura 9. CPPD. Depositi microcristallini (teste di freccia) nel contesto dello strato cartilagineo di una testa metacarpale. Immagine acquisita in scansione longitudinale dorsale di una articolazione metacarpofalangea. fp = falange prossimale; mc = metacarpo; freccia= osteofita.
Tale rilievo può essere d’aiuto nella diagnosi differenziale con altre artropatie infiammatorie. Il pattern ecografico tipico della CPPD si caratterizza per la presenza di depositi di CPP ed osteofiti in presenza di una sinovite, generalmente di basso grado, ed in assenza di erosioni ossee (Cipolletta E, et al. Rheumatology (Oxford). 2022).
Nel 2021, il nostro gruppo di ricerca ha presentato al congresso annuale dell’EULAR i risultati preliminari di uno studio volto ad identificare il miglior protocollo ecografico per la diagnosi di CPPD utilizzando l’analisi del liquido sinoviale come “gold standard”. La valutazione del ginocchio (cartilagine ialina dei condili femorali e menischi), del polso (fibrocartilagine triangolare del carpo e legamenti intrinseci del polso) e dell’anca (fibrocartilagine acetabolare) fornisce una accuratezza diagnostica superiore al 90% (Cipolletta E, et al. Ann Rheum Dis 2021).
È tuttora in fase di sviluppo un sistema di valutazione semiquantitativo dei depositi di CPP per la valutazione ecografica dell’estensione dei depositi di CPP da parte della task force dell’OMERACT (Sirotti S, et al. Ann Rheum Dis 2022). In tale sistema semiquantitativo sono state incluse le tre strutture già identificate dal gruppo OMERACT come dotate di elevata “reliability” (cartilagine ialina dei condili femorali, fibrocartilagini meniscali e fibrocartilagine triangolare del carpo) (Filippou G, et al. J Rheumatol. 2017; Filippou G, et al. Ann Rheum Dis. 2018).
Non sono ad oggi disponibili dati sull’utilizzo dell’ecografia in ambiti diversi da quello diagnostico (ad esempio nella valutazione della prognosi o nel monitoraggio della risposta alla terapia).
Punti chiave
- L’ecografia ha dimostrato di essere una metodica accurata e riproducibile nella diagnosi delle artropatie microcristalline
- L’OMERACT ha sviluppato e validato le definizioni dei principali rilievi ecografici indicativi di depositi di MSU e CPP
- Recenti studi hanno evidenziato che il ruolo dell’ecografia nella gotta non è limitato alla sola diagnosi, ma si estende anche all’aspetto prognostico e al monitoraggio della risposta alla terapia
- Nella CPPD, l’ecografia, in virtù della elevata sensibilità ed accuratezza, ha un ruolo eminentemente diagnostico
Bibliografia
- Stewart S, Su I, Gamble GD, Dalbeth N. Diagnostic value of different imaging features for patients with suspected gout: A network meta-analysis. Semin Arthritis Rheum. 2021 Dec;51(6):1251-1257. doi: 10.1016/j.semarthrit.2021.10.005. Epub 2021 Oct 28. PMID: 34763198.
- Cipolletta E, Filippou G, Scirè CA, Di Matteo A, Di Battista J, Salaffi F, Grassi W, Filippucci E. The diagnostic value of conventional radiography and musculoskeletal ultrasonography in calcium pyrophosphate deposition disease: a systematic literature review and meta-analysis. Osteoarthritis Cartilage. 2021 May;29(5):619-632. doi: 10.1016/j.joca.2021.01.007. Epub 2021 Feb 10. PMID: 33577959.
- Grassi W, Okano T, Filippucci E. Use of ultrasound for diagnosis and monitoring of outcomes in crystal arthropathies. Curr Opin Rheumatol. 2015 Mar;27(2):147-55. doi: 10.1097/BOR.0000000000000142. PMID: 25633243.
- Neogi T, Jansen TL, Dalbeth N, et al. 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative Ann Rheum Dis. 2015;74:1789-98. doi:10.1136/annrheumdis-2015-208237
- Zhang W, Doherty M, Bardin T, et al. European League Against Rheumatism recommendations for calcium pyrophosphate deposition. Part I: terminology and diagnosis. Ann Rheum Dis 2011;70:563–70. doi: 10.1136/ard.2010.139105.
- Filippucci E, Di Geso L, Grassi W. Tips and tricks to recognize microcrystalline arthritis. Rheumatology (Oxford). 2012 Dec;51 Suppl 7:vii18-21. doi: 10.1093/rheumatology/kes332. PMID: 23230088.
- Filippou G, Pacini G, Sirotti S, Zadory M, Carboni D, Damiani A, Fiorentini E, Cipolletta E, Filippucci E, Froehlich JM, Sarzi Puttini P, Becce F. Comparison of ultrasound attenuation by calcium pyrophosphate, hydroxyapatite and monosodium urate crystals: a proof-of-concept study. Ann Rheum Dis. 2022 Mar 18:annrheumdis-2022-222316. doi: 10.1136/annrheumdis-2022-222316. Epub ahead of print. PMID: 35304408.
- Terslev L, Gutierrez M, Christensen R, Balint PV, Bruyn GA, Delle Sedie A, Filippucci E, Garrido J, Hammer HB, Iagnocco A, Kane D, Kaeley GS, Keen H, Mandl P, Naredo E, Pineda C, Schicke B, Thiele R, D’Agostino MA, Schmidt WA; OMERACT US Gout Task Force. Assessing Elementary Lesions in Gout by Ultrasound: Results of an OMERACT Patient-based Agreement and Reliability Exercise. J Rheumatol. 2015 Nov;42(11):2149-54. doi: 10.3899/jrheum.150366. Epub 2015 Oct 15. Erratum in: J Rheumatol. 2017 Jan;44(1):130. PMID: 26472419.
- Christiansen SN, Filippou G, Scirè CA, Balint PV, Bruyn GA, Dalbeth N, Dejaco C, Sedie AD, Filippucci E, Hammer HB, Iagnocco A, Keen HI, Kissin EY, Koski J, Mandl P, Martin J, Miguel E, Möller I, Naredo E, Pineda C, Schmidt WA, Stewart S, Antonietta D’Agostino M, Terslev L; on the behalf of the OMERACT Ultrasound working group. Consensus-based semi-quantitative ultrasound scoring system for gout lesions: Results of an OMERACT Delphi process and web-reliability exercise. Semin Arthritis Rheum. 2021 Jun;51(3):644-649. doi: 10.1016/j.semarthrit.2020.11.011. Epub 2021 Jan 10. PMID: 33468347.
- Peiteado D, De Miguel E, Villalba A, Ordóñez MC, Castillo C, Martín-Mola E. Value of a short four-joint ultrasound test for gout diagnosis: a pilot study. Clin Exp Rheumatol. 2012 Nov-Dec;30(6):830-7. Epub 2012 Dec 17. PMID: 23020889
- Naredo E, Uson J, Jiménez-Palop M, Martínez A, Vicente E, Brito E, Rodríguez A, Cornejo FJ, Castañeda S, Martínez MJ, Sanz J, Möller I, Batlle-Gualda E, Garrido J, Pascual E. Ultrasound-detected musculoskeletal urate crystal deposition: which joints and what findings should be assessed for diagnosing gout? Ann Rheum Dis. 2014 Aug;73(8):1522-8. doi: 10.1136/annrheumdis-2013-203487. Epub 2013 May 24. PMID: 23709244.
- Norkuviene E, Petraitis M, Apanaviciene I, Virviciute D, Baranauskaite A. An optimal ultrasonographic diagnostic test for early gout: A prospective controlled study. J Int Med Res. 2017 Aug;45(4):1417-1429. doi: 10.1177/0300060517706800. Epub 2017 Jun 15.
- Christiansen SN, Østergaard M, Slot O, Fana V, Terslev L. Ultrasound for the diagnosis of gout-the value of gout lesions as defined by the Outcome Measures in Rheumatology ultrasound group. Rheumatology (Oxford). 2021;60(1):239-249. doi:10.1093/rheumatology/keaa366
- Cipolletta E, DI Matteo A, Filippucci E, et al THU0420 ULTRASOUND SHOWS GREAT ACCURACY FOR THE DIAGNOSIS OF CRYSTAL ARTHRITIS IN PATIENTS WITH RECENT-ONSET SYNOVITIS Annals of the Rheumatic Diseases 2020;79:448.
- Stewart S, Maxwell H, Dalbeth N. Prevalence and discrimination of OMERACT-defined elementary ultrasound lesions of gout in people with asymptomatic hyperuricaemia: A systematic review and meta-analysis. Semin Arthritis Rheum. 2019 Aug;49(1):62-73. doi: 10.1016/j.semarthrit.2019.01.004. Epub 2019 Jan 11. PMID: 30709689.
- Christiansen SN, Østergaard M, Slot O, Fana V, Terslev L. Retrospective longitudinal assessment of the ultrasound gout lesions using the OMERACT semi-quantitative scoring system. Rheumatology (Oxford). 2022 Mar 17:keac179. doi: 10.1093/rheumatology/keac179. Epub ahead of print. PMID: 35298610
- Cipolletta E, Di Battista J, Di Carlo M, Di Matteo A, Salaffi F, Grassi W, Filippucci E. Sonographic estimation of monosodium urate burden predicts the fulfillment of the 2016 remission criteria for gout: a 12-month study. Arthritis Res Ther. 2021 Jul 9;23(1):185. doi: 10.1186/s13075-021-02568-x. PMID: 34243813; PMCID: PMC8268270.
- Uhlig T, Karoliussen LF, Sexton J, Kvien TK, Haavardsholm EA, Perez-Ruiz F, Hammer HB. One- and 2-year flare rates after treat-to-target and tight-control therapy of gout: results from the NOR-Gout study. Arthritis Res Ther. 2022 Apr 20;24(1):88. doi: 10.1186/s13075-022-02772-3. PMID: 35443675; PMCID: PMC9020166
- Filippou G, Scirè CA, Damjanov N, Adinolfi A, Carrara G, Picerno V, Toscano C, Bruyn GA, D’Agostino MA, Delle Sedie A, Filippucci E, Gutierrez M, Micu M, Möller I, Naredo E, Pineda C, Porta F, Schmidt WA, Terslev L, Vlad V, Zufferey P, Iagnocco A. Definition and Reliability Assessment of Elementary Ultrasonographic Findings in Calcium Pyrophosphate Deposition Disease: A Study by the OMERACT Calcium Pyrophosphate Deposition Disease Ultrasound Subtask Force. J Rheumatol. 2017 Nov;44(11):1744-1749. doi: 10.3899/jrheum.161057. Epub 2017 Mar 1. PMID: 28250136.
- Filippou G, Scirè CA, Adinolfi A, Damjanov NS, Carrara G, Bruyn GAW, Cazenave T, D’Agostino MA, Delle Sedie A, Di Sabatino V, Diaz Cortes ME, Filippucci E, Gandjbakhch F, Gutierrez M, Maccarter DK, Micu M, Möller Parera I, Mouterde G, Mortada MA, Naredo E, Pineda C, Porta F, Reginato AM, Satulu I, Schmidt WA, Serban T, Terslev L, Vlad V, Vreju FA, Zufferey P, Bozios P, Toscano C, Picerno V, Iagnocco A. Identification of calcium pyrophosphate deposition disease (CPPD) by ultrasound: reliability of the OMERACT definitions in an extended set of joints-an international multiobserver study by the OMERACT Calcium Pyrophosphate Deposition Disease Ultrasound Subtask Force. Ann Rheum Dis. 2018 Aug;77(8):1194-1199. doi: 10.1136/annrheumdis-2017-212542. Epub 2018 Mar 13. PMID: 29535120.
- Cipolletta E, Di Matteo A, Smerilli G, Di Carlo M, Di Battista J, Abhishek A, Grassi W, Filippucci E. Ultrasound findings of calcium pyrophosphate deposition disease at metacarpophalangeal joints. Rheumatology (Oxford). 2022 Feb 1:keac063. doi: 10.1093/rheumatology/keac063. Epub ahead of print. PMID: 35104308.
- Cipolletta E, DI Battista J, Grassi W, et al OP0205 ULTRASOUND-DETECTED CALCIUM PYROPHOSPHATE CRYSTAL DEPOSITION: WHICH SITES SHOULD BE SCANNED? Ann Rheum Dis 2021;80:123-124.
- Sirotti S, Adinolfi A, Damiani A on behalf of OMERACT US in CPPD working group, et al OP0168 DEVELOPMENT OF AN ULTRASOUND SCORING SYSTEM FOR CPPD EXTENT: RESULTS FROM A DELPHI PROCESS AND WEB-RELIABILITY EXERCISE BY THE OMERACT US WORKING GROUP Ann Rheum Dis 2022;81:110-111.
