L’ECOGRAFIA TORACICA NELLO STUDIO DELL’INTERSTIZIOPATIA POLMONARE IN CORSO DI MALATTIE DEL CONNETTIVO
AUTORI:
Marika Tardella1
1Clinica Reumatologica-Dipartimento di Scienze Cliniche e Molecolari – Università Politecnica delle Marche,
L’interstiziopatia polmonare in corso di malattie del connetttivo
Le malattie del connettivo (MC) sono un gruppo eterogeneo di malattie a patogenesi autoimmune, il cui quadro clinico può manifestarsi con l’interessamento infiammatorio di uno o più organi. In base alle manifestazioni cliniche, pertanto, si può avere un quadro clinico sfumato o paucisintomatico, riconducibile nel contesto di una connettivite non differenziata (Mosca, M., et al. J. Autoimmun. 2014), o si può assistere all’interessamento multiorgano con o senza un profilo autoimmunitario specifico, tali da soddisfare i criteri diagnostici per una connettivite maggiore (lupus eritematoso sistemico(Aringer, M. et al. Arthritis Rheumatol. 2019), sclerosi sistemica (van den Hoogen, F. et al. Arthritis Rheum. 2013), sindrome di Sjogren (Shiboski, C. H. et al. Ann. Rheum. Dis. Arthritis Rheum 2016), miositi infiammatorie croniche (Selva-O’Callaghan, A. et al. Lancet Neurol. 2018), connettivite mista (Ortega-Hernandez, et al. Best Pract. Res. Clin. Rheumatol. 2012).
Tra gli organi più colpiti in corso di malattie di connettivo troviamo il polmone. L’incidenza dell’impegno polmonare varia nelle diverse malattie in base al disegno dello studio e alla metodica utilizzata per l’indagine polmonare (Salaffi, F. et al. Med. 2019). L’apparato respiratorio può essere coinvolto in ogni suo elemento, dall’albero bronchiale superiore (malattie delle vie aeree superiori, bronchite ostruttiva), al parenchima polmonare (interstiziopatia fibrosante), all’albero vascolare (ipertensione arteriosa polmonare), fino alla pleura (sierosite) e alla muscolatura toracica. Inoltre, a complicare il complesso scenario, il polmone può essere sede di una complicanza infettiva o di un danno farmacologico immunomediato secondario (Bouros, D., et al. Respiration 2015).
Le patologie polmonari in corso di malattie del connettivo di maggiore interesse sia per frequenza che per severità sono l’interstiziopatia polmonare diffusa (F.V., C. & J., V. Arthritis Res. Ther. 2010), di cui parleremo in questa revisione, e l’ipertensione arteriosa polmonare (Thakkar, V. et al. Best Pract. Res. Clin. Rheumatol. 2016). L’interessamento polmonare può essere la manifestazione d’esordio della connettivite nel 15% del casi (Fischer, A. Lancet 2012) e, seppur in rari casi, può rimanere l’unico organo interessato, la cosiddetta “polmonite interstiziale con carattere autoimmune”(Fernandes, L., Front. Med. 2019).
L’interstiziopatia polmonare diffusa (IPD) si definisce come una condizione caratterizzata dalla presenza di un infiltrato infiammatorio dell’interstizio polmonare associato a fibrosi, con conseguente distorsione dell’interstizio stesso (Myers, J. Semin. Diagn. Pathol. 2018). Le forme secondarie a malattie del connettivo fanno parte di un gruppo di IPD, di cui le più frequenti sono la fibrosi polmonare idiopatica, la sarcoidosi e le polmoniti eosinofile (Fischer, A. Lancet 2012). La classificazione istologica e radiologica della IPD in corso di malattia del connettivo è stata ereditata da quella della fibrosi polmonare idiopatica, ma nella pratica clinica reumatologica questo dato ha importanza ridotta, sia in termini prognostici che terapeutici, rispetto alle forme idiopatiche (Travis, W. D. et al. Am. J. Respir. Crit. Care Med. 188, 733–748 (2013).
La IPD in corso di malattia del connettivo (IPD-MC) può manifestarsi in modo eterogeneo, che dipende sia dall’estensione dell’interessamento fibrotico-infiammatorio che dalle caratteristiche cliniche del paziente (età, comorbidità). L’esordio può essere acuto o subacuto, ma nella maggior parte dei casi si ha un esordio subdolo. Le manifestazioni cliniche principali sono la tosse secca e la dispnea da sforzo. In alcuni casi vi può essere una evoluzione clinica verso l’insufficienza respiratoria cronica con necessità di supporto di ossigeno. L’obiettività clinica può essere silente, in particolare nelle fasi iniziali, o rivelare la presenza di rumori secchi teleinspiratori polmonari, tipo “rumore del velcro”, l’ippocratismo digitale e, nelle fasi avanzate, tachipnea anche a riposo (Wells, A. U. et al Nat. Rev. Rheumatol 2014).
L’esame gold standard per la diagnosi di IPD-MC è la biopsia (McLean-Tooke, A., et al Clin. Transl. Immunol. 2019), ma per le rilevanti complicanze della procedura e per la scarsa utilità della tipizzazione istologica nella pratica clinica quotidiana, si utilizza ai fini diagnostici la tomografia assiale computerizzata ad alta risoluzione (TCAR) del torace (Travis, W. D. et al. Am. J. Respir. Crit. Care Med. 188, 733–748 (2013). Il vantaggio della TCAR è quello di fornire rilievi anatomici dettagliati sia per quanto riguarda la distribuzione che per il tipo di danno interstiziale. Sulla base dei rilievi radiografici si riesce a definire dei quadri caratteristici: quando prevale il vetro smerigliato in maniera disomogenea e con risparmio delle regioni subpleuriche si parla di polmonite interstiziale non specifica (non specific interstitial pneumonia – NSIP), in caso addensamenti polmonari bilaterali si delinea una polmonite organizzativa criptogenica (cryptogenic organizing pneumonia – COP), in caso di danno fibrotico subpleurico con formazione di microcisti subpleuriche, definite a “nido d’ape”, e bronchioloectasie da trazione si parla di interstiziopatia polmonare usuale (usual interstitial pneumonite – UIP). Si possono inoltre trovare dei quadri meno frequenti, tra cui la polmonite intersitiziale linfoide (linfoid interstitial pneumonite – LIP), tipica della sindrome di Sjogren, caratterizzata dalla presenza di lesioni cistiche diffuse del parenchima, e quadri misti, frequenti nelle miositi infiammatorie croniche.
Nelle polmoniti interstiziali le prove di funzionalità respiratoria evidenziano un quadro restrittivo e una riduzione della diffusione del monossido di carbonio (DLco), seppur a volte si può avere un quadro misto alla luce anche dell’impegno bronchiale (Ciancio, N. et al. Multidiscip. Respir. Med. 2019). La radiografia standard del torace può rivelare la presenza di un aumento della trama interstiziale o aree di opacità diffuse a margini mal delimitati. Sia la radiografia del torace che le prove di funzionalità polmonare hanno una bassa sensibilità nel rilevare la presenza di interstiziopatia, in particolare nelle fasi precoci della malattia. Ne deriva che in molti casi l’IPD-MC può sfuggire ad una diagnosi precoce, momento in cui la terapia può risultare più efficace rispetto ad una fase più avanzata. D’altra parte, non è possibile sottoporre sistematicamente tutti i pazienti affetti da malattia del connettivo ad una TCAR del torace, sia per l’esposizione a radiazioni ionizzanti che per il costo elevato dell’esame (Bernstein, E. J., et. al Arthritis Rheumatol. 2018), per cui sono oggetto di studio metodologie di indagine alternative ad elevata sensibilità diagnostica come esame di screening.
Ruolo dell’ecografia toracica nello studio dell’interstiziopatia polmonare secondaria a malattie del connettivo
REVISIONE DELLA LETTERATURA
Negli ultimi venti anni ha acquistato un crescente interesse l’applicazione dell’ecografia toracica (ET) nello studio dell’IPD-MC. In passato si credeva che l’ET non potesse essere applicata allo studio del polmone in quanto la presenza di un marcata differenza di impedenza acustica tra aria alveolare e tessuti connettivi circostanti determina la completa riflessione delle onde ultrasonografiche. Tale fenomeno fisico determina la formazione di una “linea pleurica” iperecogena a livello dello schermo, subito sotto la parete muscolare toracica che delimita esternamente il parenchima polmonare, che appare come un campo isoecogeno (Fig 1).
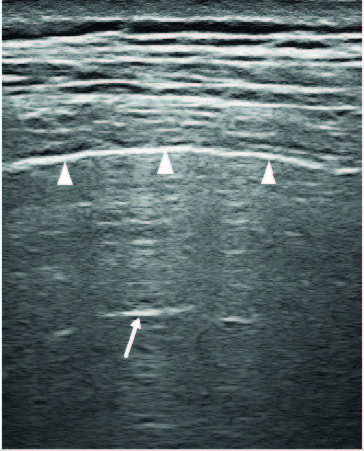
Figura 1. Linea pleurica e parenchima polmonare nel soggetto sano. La linea pleurica (teste di freccia) nel soggetto sano risulta come una linea bianca iperecogena, curvilinea ed omogenea, di spessore inferiore ai 2 mm. Nella zona dell’immagine sovrastante la linea pleurica si rilevano strutture connettivali e muscoli che compongono la parete toracica, mentre nella zona sottostante si rileva polmone sano, normoareato che si presenta come una zona isoecogena e un’artefatto da ripetizione, definito Linea A (freccia).
Un cambio di tendenza si è avuto con l’applicazione dell’ET nella valutazione del polmonare “malato”. Infatti, quando il contenuto aereo fisiologico polmonare è sostituito da altro tessuto, come per esempio tessuto connettivo, infiltrato infiammatorio o liquido, come avviene nella fibrosi polmonare, nella polmonite o nell’edema polmonare cardiogeno, la completa riflessione delle onde ultrasonore si riduce per cui esse riescono ad essere trasmesse all’interno del tessuto polmonare e “leggere” dei nuovi rilievi. Già Dorne nel 1986 pubblicava un caso clinico di un paziente affetto da polmonite basale sinistra in cui veniva confrontato il rilievo ecografico con le immagini ottenute dalla TCAR: la presenza di infiltrato infiammatorio nella regione subpleurica, associato a persistenza del broncogramma aereo veniva evidenziato, ad una scansione ecografia sottodiaframmatica sinistra, come una regione moderatamente ecogenica adesa al diaframma, nel cui contesto si rilevavano piccole regioni rotondeggianti anecogene. Tali rilievi hanno permesso di evidenziare il parenchima polmonare “addensato” e la presenza del broncogramma aereo, tipici della polmonite lobare(Dorne, H. L. Radiology 1986) (Fig. 2).
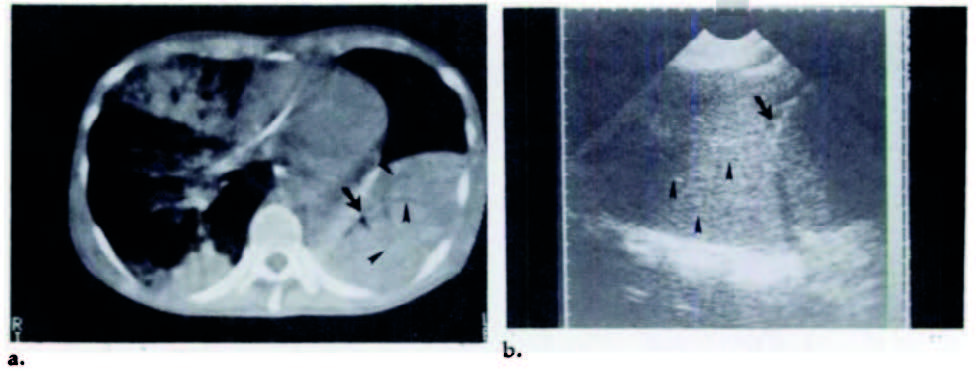
Figura 2. Polmonite lobare sinistra. (a) Immagine di una tomografia computerizzata senza mezzo di contrasto a livello della regione toracica subilare che mostra liquido (teste di freccia) e aria (freccia) nei bronchi circondati da consolidazione del lobo polmonare inferiore sinistro. (b) ecografia toracica del torace sinistro, scansione orizzontale, eseguito subito dopo la tomografia computerizzata, che mostra una area ecogenica che contiene strutture tubulari multiple (teste di freccia) sopra il diaframma (freccia).
Nel 1997 Lichtenstein e coll. hanno applicato l’ET a 121 pazienti, la cui radiografia del torace convenzionale mostrava ispessimento della trama bronco-interstiziale, definita dagli autori “sindrome alveolare-interstiziale”. Ha inoltre confrontato i dati con quelli di un gruppo di controllo di 129 pazienti senza ispessimento polmonare interstiziale (Lichtenstein, D., et al. Am. J. Respir. Crit. Care Med.1997). Nei pazienti affetti da “sindrome alveolare interstiziale” emergeva la presenza di un artefatto ecografico “a coda di cometa” in corrispondenza delle zone affette da ispessimento dei setti alveolari o da aree a vetro smerigliato, rilevate alla TCAR del torace. Gli autori definivano “artefatto a coda di cometa” un’immagine iperecogena da riverbero dell’onda ultrasonografica, a base stretta, che origina dalla linea pleurica e, come un raggio laser, si proietta fino al margine opposto dello schermo, muovendosi contestualmente agli atti respiratori (Fig. 3a). I rilievi sono da considerarsi patologici se multipli (almeno tre in una scansione longitudinale tra due coste) e ad una distanza inferiore o uguale a 7±1mm. Nei pazienti che non mostravano artefatti “a coda di cometa” l’ET mostrava linee iperecogene orizzontali a partenza dalla linea pleurica e disposte ad una distanza costante tra di loro (Targhetta, R. et al. J. Ultrasound Med. 1992). Nel polmone sano la presenza di aria alveolare determina una riflessione massiva e omogenea delle onde ultrasonore, creando un artefatto ecografico di tipo riflessione ripetitiva orizzontale. Tali linee orizzontali vennero chiamate linee A (Fig. 2). La linea pleurica è un elemento facilmente visualizzabile all’ET, in quanto nei soggetti sani si riscontra nella regione superiore dello schermo come una linea curva, iperecogena ed omogenea, di circa 2 mm di spessore, situata al di sotto della muscolatura del torace (Soldati, G., et al. J. Ultrasound Med. 2009).
Gli artefatti “a coda di cometa” che vennero definiti successivamente linee-B, possono avere una densità variabile, ma devono sempre distinguersi tra loro. Quando questo non accade e si ha una fusione di numerose linee-B, il polmone presenta una ecogenicità aumentata ed omogenea, tale da esser definito “polmone bianco”(Soldati, G., et al. European Review for Medical and Pharmacological Sciences 2011) (Fig. 3b).
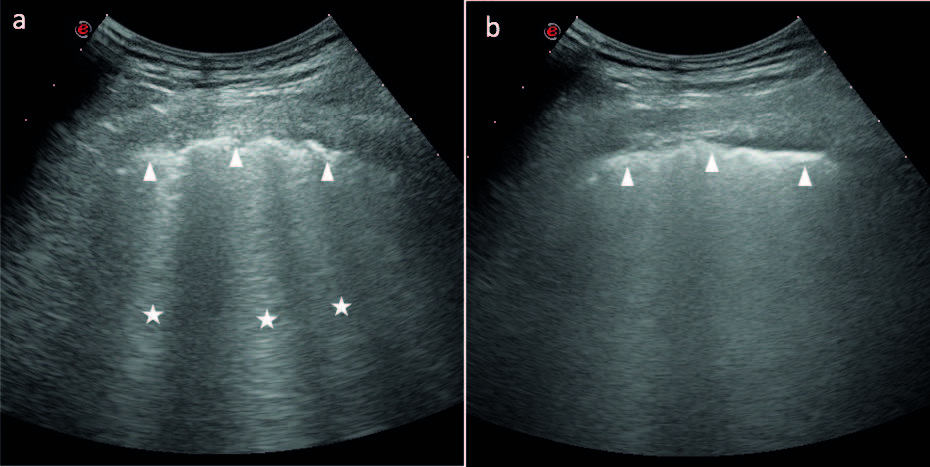
Figura 3. (a) Artefatto “a coda di cometa” o linea B. La linea pleurica (teste di freccia) appare disomogea ed ispessita e da essa origina l’artefatto da riverbero, tipo laser, che si proietta fino all’estremo opposto dello schermo, definito linea B. (b) Le linee B non sono più distinguibili tra loro per cui si forma un’immagine iperecogena, definita polmone bianco. Da notare la perdita delle linee A nel polmone patologico.
Nella letteratura internazionale il maggior numero di articoli sulla ET in corso di MC riguarda la Sclerosi sistemica (SSc), in quanto l’incidenza dell’IPD in questa malattia è più alta che in altre connettiviti. Il primo studio risale al 2009 in cui sono stati arruolati 33 pazienti affetti da SSc a cui è stata eseguita una ET, utilizzando un trasduttore cardiaco a 2,5-3,5 MHz, nel torace anteriore, medio e posteriore (Gargani, L. et al. Rheumatology (Oxford) 2009. Sono stati inclusi 62 spazi intercostali polmonari (SI) con un tempo medio di esame di 10 minuti. I dati ecografici sono stati correlati con i quelli della TCAR, utilizzando il punteggio proposto da Warrick et al. (Warrick, J. H., et al. J. Rheumatol. 1991), ed è stata ottenuta una correlazione lineare tra i dati ET e TCAR e una correlazione significativa tra il numero di linee B e i valori di DLco. Lo stesso gruppo di autori ha condotto uno studio su 25 pazienti per confrontare i risultati dell’ET ottenuti con due diverse sonde: una sonda cardiaca a 2,5-3,5-3,5 MHz e una sonda lineare a 6-12 MHz utilizzata a 6 MHz, e con i dati della TCAR (Sedie, A. D. et al. Clinical and Experimental Rheumatology 2010). Anche in questo caso hanno trovato una correlazione significativa tra le valutazioni ecografiche ottenute con entrambi i trasduttori e una moderata e buona correlazione tra sonda cardiaca e la TCAR (ICC = 0,547) e sonda lineare e TCAR (ICC = 0,600).
Un ulteriore studio ha valutato 34 pazienti consecutivi con diverse MC (26 SSc, 2 affetti da sindrome di Sjögren, due affetti da sindrome da anticorpi antisinthetasi, due da dermatomiosite, uno affetto da connettivite mista e uno da connettivite non differenziata)(Tardella, M. et al. J. Rheumatol. 2012). Le valutazioni della ET sono state eseguite su 50 SI nel torace anteriore, medio e posteriore, con un trasduttore convesso multifrequenza di 2-7 MHz, utilizzando un tempo medio di 23 minuti per ogni paziente. Gli autori hanno correlato i risultati della ET con il test di funzionalità polmonare (PFT), con la DLco e con il punteggio TCAR proposto da Warrick. Inoltre, per determinare la gravità della IPD, hanno proposto un punteggio semiquantitativo dell’ ET: grado 0 = normale (< 10 linee B); grado 1 = leggero (da 11 a 20 linee B); grado 2 = moderato (da 21 a 50 linee B); e grado 3 = marcato (> 50 linee B), andando a contare le linee B complessivamente sui 50 SI studiati. Hanno trovato una correlazione positiva tra i dati ET e i valori DLco e, in aggiunta, una significativa correlazione lineare tra il punteggio semiquantitativo e il punteggio di Warrick. L’affidabilità interosservatore tra due ecografisti nella rilevazione delle linee B è stata eccellente. Un numero maggiore di linee B è stato osservato negli SI a livello delle regioni posteriori inferiori del torace, che sono state proposte dagli autori come i primi SI da valutare nella fase iniziale dell’IPD.
Lo stesso gruppo ha proposto una valutazione semplificata della ET, effettuando un’analisi post hoc (Gutierrez, M. et al. Arthritis Res. Ther. 2011). Essi hanno sottoposto 36 pazienti consecutivi con MC ad una valutazione ecografica con un trasduttore convex multifrequenza di 2-7 MHz. La valutazione è stata eseguita su 50 SI dove sono state contate il numero delle linee B per singolo SI e quindi ottenuto uno score totale dato dalla somma di ogni singolo SI. Sono stati quindi scelti quattordici SI in cui è stata ottenuta la maggior prevalenza di linee B: il secondo SI lungo le linee parasternali, il quarto SI lungo le linee emiclaveari, le linee ascellari anteriori e medie e l’ottavo SI lungo le linee ascellari posteriori, paravertebrali e sottoscapolari. Gli autori hanno pertanto proposto un punteggio ET “semplificato”: 0 = normale, (< 5 linee B); 1 = leggero (da 6 a 15 linee B); 2 = moderato (da 16 a 30 linee B) e 3 = marcato (> 30 linee B), ed hanno trovato una correlazione significativa tra lo score ET completo e quello semplificato (p = 0,0001) e una correlazione positiva tra il punteggio ET semplificato e il punteggio TCAR (p = 0,0006), sia nella quantificazione che nell’estensione dell’IPD. Un risultato degno di nota è la significativa differenza nel tempo medio impiegato per effettuare la valutazione ecografica semplificata (8,3 min) rispetto alla valutazione completa.
Un ulteriore elemento ecografico è stato introdotto da Moazedi-Fuerst et al. che hanno studiato le caratteristiche ecografiche della “linea pleurica”(Moazedi-Fuerst, F. C. et al. Clin. Rheumatol. 2012). Essi hanno sottoposto ad ET 25 pazienti con SSc e SSc molto precoce e 40 volontari sani, ed hanno correlato i dati ET con la TCAR. Hanno definito irregolarità pleurica come l’ispessimento della linea pleurica maggiore di 2,8 mm e hanno anche dato un punteggio in base ai rilievi patologici ottenuti: 0 = senza aree di irregolarità, 1 = 1-5 aree di irregolarità pleurica e 2 = > 5 aree di irregolarità pleurica. Gli autori hanno trovato le linee B nel 7% dei soggetti sani e nel 44% dei pazienti con IPD, confermata dalla TCAR e che tutti i pazienti con linee B hanno mostrato anche significative irregolarità pleuriche. Tale rilievo evidenzia l’importanza dello studio delle caratteristiche della linea pleurica aprendo una nuova area di ricerca ET.
Barskova et al. hanno condotto uno studio pilota sull’utilizzo dell’ET come test di screening per la ricerca di IPD (Barskova, T. et al. Ann. Rheum. Dis. 2013). Hanno arruolato 58 pazienti con SSc, tra cui 32 pazienti con SSc molto precoce, sottoponendo i pazienti a ET su 62 SI, utilizzando un trasduttore cardiaco a 2,5-3,5 MHz. L’IPD, rilevata alla TCAR, è stato osservato nel 41% della popolazione con SSc molto precoce. Hanno trovato il 100% di sensibilità e il 59% di specificità quando il numero totale di linee B era > 5, e un accordo dell’83% tra TCAR e ET per il rilevamento dell’IPD. I casi discrepanti sono stati determinati da dati falsi positivi rilevati con ET, fornendo un valore predittivo negativo al 100% sia in SSc che in SSc precoce.
Mohammadi et al. hanno proposto un sistema di punteggio ridotto per la valutazione del ET (Mohammadi, A., et al Med. Ultrason. 2014) . Gli autori hanno eseguito uno studio trasversale su 70 pazienti con SSc, correlando i dati di ET con la TCAR come standard di imaging per indagare la sua concomitante validità. La valutazione della ET è stata eseguita su dieci LIS: per il torace anteriore il quarto SI lungo la linea emiclaveare; per il torace laterale il quarto SI lungo le linee ascellari anteriori e medie; per il torace posteriore: l’ottavo SI lungo le linee ascellari posteriori e sub-scapolari. Una correlazione positiva tra i dati della ET e l’entità del coinvolgimento polmonare alla TCAR è stata rilevata, con conseguenti sensibilità, specificità, valore predittivo positivo e negativo del 73,58%, 88,23%, 95,12% e 51,72%, rispettivamente, rispetto alla TCAR.
Sperandeo et al. hanno proposto un nuovo metodo per valutare le anomalie pleuriche (ispessimento, noduli pleurici/subpleurici e altre anomalie polmonari subpleuriche), eseguendo una valutazione ET di tutti gli SI toracici, utilizzando una sonda convessa a 3,5-5-MHz (Sperandeo, M. et al. Scand. J. Rheumatol. 2015). Lo scopo dello studio era quello di valutare la capacità dell’ET di rilevare lo spessore della linea pleurica (nel paziente sano risulta < 3,0 mm) per lo studio dell’IPD subclinica in pazienti con SSc e per pianificare la valutazione HRCT. Sono stati eseguiti ET e TCAR in 175 pazienti con SSc. L’ispessimento della linea pleurica (3,0-5,0 mm) è stato riscontrato in 97 pazienti, i noduli subpleurici in 32 pazienti e l’ispessimento della linea pleurica maggiore di > 5,0 mm in 35 pazienti, mentre uno spessore normale della linea pleurica in 26 pazienti senza IPD. Tutti i dati ecografici ottenuti hanno mostrato un buon accordo con il punteggio della TCAR, classificato come fibrosi polmonare estesa (che coinvolge sicuramente il polmone medio-alto), fibrosi polmonare limitata o basale (che coinvolge solo il polmone posteriore della base inferiore) o fibrosi polmonare assente (nessun segno apparente).
In accordo con lo studio precedente, Buda et al. hanno proposto dei nuovi parametri ecografici da tenere in considerazione nella ricerca della IPD: irregolarità della linea pleurica, restringimento della linea pleurica, frammentazione della linea pleurica, sfocatura della linea pleurica, ispessimento della linea pleurica, artefatti della linea B ≤ 3 e consolidamenti subpleurici < 5 mm (Buda, N., et al. Ultraschall der Medizin 2016). Hanno eseguito uno studio su 52 pazienti affetti da IPD-MC e 50 soggetti sani, che venivano sottoposti a valutazione ET e TCAR, utilizzando il punteggio di Warrick. Hanno valutato tutti gli SI, dividendoli in campi superiori, medi e inferiori. L’irregolarità della linea pleurica è stata riscontrata più spesso nei campi inferiori di entrambi i polmoni (100% dei pazienti affetti da IPD). Il risultato patologico rilevato più frequentemente è stato un ispessimento della linea pleurica (spessore ≥ 3 mm), principalmente nei campi polmonari inferiori nei pazienti con SSc, mentre nei casi più gravi di IPD è stata rilevata una linea pleurica sfocata, che viene rilevata nei pazienti con rilievo di “polmone a nido d’api” alla TCAR. La sensibilità e la specificità della linea pleurica sfocata sono state rispettivamente di 0,59 e 0,82. Le linee B sono state osservate nel 92,3% dei pazienti con SSc, di cui il 69,3% aveva numerose linee B (≥ 4), soprattutto nei campi inferiori. Le linee B sono state osservate anche nei campi centrale e superiore quando l’ILD era molto estesa. Gli autori hanno anche notato che numerosi artefatti tipo linea B si verificano quando è presente una linea pleurica sfocata (p < 0,001). Gli autori forniscono la definizione di “sindrome del polmone bianco”, quando alla ET sirilevano numerosi artefatti tipo linea B che si dissolvono in un unico grande artefatto verticale, soddisfando in questo modo la definizione di linea B e mostrando una forte correlazione con la presenza di opacità “a vetro smerigliato” alla TCAR; sensibilità e specificità sono state rispettivamente di 0,95 e 0,99.
Nel 2016 Gigante et al. hanno condotto uno studio con l’obiettivo di correlare i risultati di ET, TCAR e funzionalità polmonare in 39 pazienti con SSc, incluso il punteggio cutaneo di Rodnan modificato come variabile clinica (Gigante, A. et al. Intern. Emerg. Med. 2016). È stata trovata una correlazione positiva tra il numero di linee B e il punteggio alla TCAR (r = 0,81, p < 0,0001); gli autori hanno mostrato una correlazione negativa tra il numero di linee B e DLco (r = – 0,63, < 0,0001), mentre non è stata ottenuta una correlazione significativa tra i dati di ecografici e il punteggio cutaneo di Rodnan.
Quarantotto pazienti consecutivi con SSc sono stati valutati anche da Cakir et al. in uno studio il cui scopo era indagare la capacità della ET di valutare la gravità della IPD-SSc (Çakir Edis, E. et al. Arch. Rheumatol. 2016). In questo studio gli autori hanno dimostrato una buona correlazione tra le linee B e la TCAR (r = 0,89; p = 0,0001). Sensibilità, specificità, valore predittivo positivo e valore predittivo negativo dei dati ET erano rispettivamente 100, 84,2, 90,6 e 100%, quando la TCAR è stata presa come gold standard.
Nel 2018 un gruppo di ricercatori ha progettato uno studio trasversale per determinare un cut-off del numero di linee B totali per rilevare la presenza di IPD significativa in 40 pazienti SSc consecutivi in relazione al punteggio di Warrick (Tardella, M. et al. Med. 2018). Gli autori hanno adottato il precedente punteggio ET su 14 SI (Gutierrez, M. et al. Arthritis Res. Ther. 2011) e hanno dimostrato che un valore di 10 linee B è altamente predittivo per la presenza di IPD significativa in TCAR, utilizzando come criterio esterno un punteggio di Warrick di 7. Gli autori hanno inoltre rilevato che il punteggio totale dell’ET correla significativamente con la DLco e moderatamente con le misure di qualità della vita.
Nello stesso anno Hassan et al. hanno condotto uno studio prospettico di coorte per dimostrare che l’ET è uno strumento di screening utile per l’IPD in pazienti con SSc (Hassan, R. I. et al. Journal of Clinical Rheumatology 2019). Questo studio ha coinvolto 67 pazienti con SSc. In 29 pazienti con TCAR patologica (punteggio di Warrick > 7) e ET, due avevano un punteggio basso (6-15 linee B) e 27 avevano un punteggio moderato o grave (≥ 16 linee B). Dei 38 pazienti con TCAR normale, 25 avevano un certo grado di coinvolgimento polmonare alla ET. L’ET ha riportato una sensibilità del 100% e una specificità del 34%. È stata dimostrata una correlazione significativa tra il numero di linee B e la presenza di IPD alla TCAR (area sotto la curva, 0,80; intervallo di confidenza del 95%, 0,69-0,90).
Nella letteratura sono stati eseguiti studi con l’applicazione dell’ET anche in pazienti affetti da ILD e MC diverse da SSc. Aghdashi M. et al. hanno valutato una coorte di 31 pazienti affetti da artrite reumatoide (AR) con sospetto coinvolgimento polmonare (Aghdashi, M., et al. Int. J. Clin. Exp. Med. 2013). I pazienti inclusi sono stati sottoposti a valutazioni di TCAR ed ET. Prendendo la TCAR come gold-standard, gli autori hanno ottenuto valori di sensibilità, specificità, valori predittivi positivi e negativi della ET del 73,58%, 88,23%, 95,12% e 51,72%, rispettivamente.
Cogliati et al. hanno effettuato una valutazione ET su 39 pazienti affetti da AR per verificarne l’accuratezza nella diagnosi di IPD, utilizzando una sonda ecografica standard e un dispositivo tascabile (Cogliati, C. et al. Rheumatol. UK 2014). È stata eseguita una scansione completa ET su 72 SI (28 anteriori e 44 posteriori) ed il numero di linee B > 10 è stato considerato indicativo di IPD. La sensibilità e la specificità dello ET con strumento standard rispetto alla TCAR sono state rispettivamente del 92% e del 56%, mentre quelle ottenute con strumento portatile sono risultate rispettivamente dell’89% e del 50%.
Un elemento interessante è stato introdotto da Hasan et al. che hanno studiato l’accuratezza della ET nella diagnosi di IPD confrontandola con i dati alla TCAR toracico (incluso il vetro smerigliato, la pattern reticolare, nodulare o a nido d’api) e quelli di funzionalità polmonare (Hasan, A. A. et al. Ann. Thorac. Med. 2014) . Sono stati inclusi 61 pazienti con IPD secondaria a diverse malattie, tra cui otto casi con MC. La valutazione della ET è stata effettuata utilizzando una sonda convessa da 3,5 MHz. Gli autori hanno diviso il torace in quattro aree e hanno definito una regione positiva quando tre o più linee B venivano contate in almeno uno SI della stessa regione e hanno definito un esame come positivo quando c’erano due o più regioni positive bilateralmente. Tutti i pazienti hanno mostrato linee B bilaterali che correlavano positivamente con la gravità del punteggio TCAR proposto da Warrick. Il nuovo elemento di questo studio è stata la valutazione della distanza tra due linee B adiacenti: l’opacità del vetro smerigliato su TCAR correlata con una distanza di 3 mm, mentre la presenza dia nido d’ape correla con una distanza di 7 mm.
Moazedi-Fuerst et al. hanno proposto uno studio trasversale per stimare il valore della ET come strumento di screening diagnostico in pazienti con AR che non mostravano segni clinici o sintomi di ILD (Moazedi-Fuerst, F. C. et al. Clin. Exp. Rheumatol. 2014). Sessantaquattro pazienti con AR e 40 volontari sani sono stati inclusi come gruppo di controllo. I ricercatori hanno ricercato non solo la presenza di linee B, ma anche le irregolarità pleuriche, introducendo questo nuovo aspetto nello studio dell’IPD nella AR. La ET ha rilevato la presenza noduli subpleurici o linee B nel 28% dei pazienti con RA, rilievo che veniva confermato dalla TCAR che mostrava segni di malattia polmonare interstiziale subclinica. D’altra parte, la ET ha mostrato anomalie sporadiche nel 7% dei controlli sani.
Recentemente, gli stessi autori hanno condotto un nuovo studio con l’obiettivo di determinare il valore diagnostico della ET nella diagnosi di IPD in pazienti con MR [AR, SSc e lupus eritematoso sistemico (LES)](Moazedi-Fuerst, F. C. et al. Clin. Exp. Rheumatol. 2015). Quarantacinque pazienti (25 con AR, 14 con SSc e sei con LES) e 40 soggetti sani sono stati sottoposti a ET e TCAR. Il ventotto per cento della coorte affetta da AR, il 64% dei pazienti con SSc e il 66,7% dei pazienti con LES hanno mostrato un certo grado di IPD alla TCAR. I risultati patologici all’ET sono stati significativamente più frequenti nel gruppo di pazienti con IPD rispetto a quelli senza IPD (linee B: 100% vs. 12%, p < 0,001; nodi subpleurici: 55% vs. 17%, p = 0,006; ispessimento della linea pleurica: 95% vs. 12,5%, p < 0,001). I noduli subpleurici erano presenti alla ET nel 100% dei pazienti con RA contro il 22% dei pazienti SSc (p = 0,003) e nel 50% dei pazienti SLE (p = 0,049) con ILD. Una linea pleurica irregolare o ispessita (> 3 mm) è stata documentata nel 100% dei pazienti con SSc e LES con IPD, rispetto all’86% dei pazienti con AR-IPD.
Pinal-Fernandez et al. propongono di considerare la linea pleurica irregolare come nuovo segno ecografico di determinazione della IPD nei pazienti con SSc e sindrome da anticorpi antisintetasi (ASS)(Pinal-Fernandez, I. et al. Clin. Exp. Rheumatol. 2015). Nel loro studio, tutti i pazienti hanno eseguito TCAR, PFR, DLCO ed ET. Le irregolarità pleuriche e le linee B sono state ricercate su 72 SI, mentre le anomalie polmonari alla TCAR sono state quantificate dal punteggio di Warrick. Sono stati inclusi 37 pazienti (21 con ASS-2 senza ILD e 16 con SSc-6 senza ILD). Questo studio ha riportato una correlazione positiva tra il pattern ET di irregolarità pleuriche e il punteggio di Warrick in entrambi i gruppi di pazienti, indicando le irregolarità pleuriche come miglior predittore di IPD rispetto alle linee B.
Recentemente, Vasco et al. hanno studiato l’accuratezza della ET per diagnosticare l’IPD nella sindrome di Sjögren, in pazienti con alterazioni delle PFR o sintomi respiratori (Vasco, P. G. et al. Intern. Emerg. Med. 2017). La ET è stata correlata con la TCAR toracica mostrando una elevata sensibilità, specificità e probabilità positiva di rilevare l’IPD.
Come comportarsi negli stadi preclinici della malattia rimane un argomento dibattuto (Hassan, R. I. et al. Journal of Clinical Rheumatology 2019). A questo proposito, un recente studio di Gutierrez et al. è stato condotto in 133 pazienti con SSc, sottoposti ad ET e TCAR ed ha mostrato che il 40,6% dei pazienti mostra segni di ILD subclinica rispetto ai controlli sani (4,8%) (p = 0,0001)(Gutiérrez, J. et al. EULAR 2018). I dati preliminari dimostrano che la sensibilità e la specificità della ET nel rilevare un’IPD significativa sono rispettivamente del 91,2% e dell’88,6% e conferma il cut-off di 10 linee B per indirizzare il paziente ad eseguire una TCAR.
Conclusione
L’identificazione e la quantificazione delle manifestazioni precoci di IPD sono un obiettivo importante per migliorare la qualità della vita e la prognosi dei pazienti affetti da MC(Cappelli, S. et al. European Respiratory Review 2015) . La ET ha dimostrato un’elevata sensibilità nella rilevazione dei segni indicativi di ILD, anche nelle fasi iniziali della malattia e, soprattutto, un elevato valore predittivo negativo, per cui può essere proposta come strumento di screening nella valutazione dell’IPD. Il vantaggio inoltre di non utilizzare radiazioni ionizzanti e la sua semplicità di esecuzione, anche a letto del paziente, non fanno che supportare questa proposta. La ET ha infatti dimostrato una elevata validità, affidabilità e fattibilità rispetto alla TCAR, per cui potrebbe essere considerata un’eccellente metodologia per stabilire la corretta tempistica nell’esecuzione dello studio tomografico nella valutazione dell’IPD.
Nonostante i risultati ottenuti dagli studi eseguiti negli scorsi anni c’è ancora molto da fare e alcuni punti cruciali devono essere discussi. In primo luogo, gli studi attualmente disponibili hanno incluso piccole coorti di pazienti, che non permettono conclusioni strutturate. In secondo luogo, occorre definire con precisione come eseguire un esame ecografico standardizzato del polmone, in particolare in termini di quali e quanti SI valutare. Attualmente, il numero di SI utilizzato negli studi è molto variabile, da 10 a 72. In terzo luogo, non c’è consenso sul sistema di punteggio semiquantitativo per la quantificazione della IPD.
D’altra parte, stanno emergendo nuove possibilità di interpretazione dei risultati patologici, in particolare per quanto riguarda le anomalie pleuriche, che sembrano correlare adeguatamente con specifici rilievi della TCAR come l’opacità a vetro smerigliato e la fibrosi estesa e potrebbero quindi essere considerate un biomarcatore di imaging della IPD (Sperandeo, M. et al. Scand. J. Rheumatol. 2015).
In conclusione, le applicazioni di questo metodo di imaging sono ancora in crescita, ed è probabile che si presentino ulteriori opportunità di approfondimento alla luce del vivace interesse sull’argomento.
Punti chiave
- L’esame principale nello studio della interstiziopatia polmonare è la tomografia assiale ad alta risoluzione, che permette di definirne il tipo di danno e l’estensione
- L’ecografia polmonare rappresenta un valido mezzo di studio del polmone affetto da interstiziopatia polmonare, in particolare nelle fasi iniziali come esame di screening
- L’artefatto ecografico polmonare “a coda di cometa” o linea B si identifica come una linea iperecogena, tipo laser, che origina dalla linea pleurica e si proietta fino alla fine dello schermo, muovendosi consensualmente con gli atti del respiro
- La linea pleurica in corso di interstiziopatia polmonare si manifesta come una linea iperecogena, disomogena, frastagliata ed ispessita rispetto al soggetto sano.
Bibliografia
- Mosca, M., Tani, C., Vagnani, S., Carli, L. & Bombardieri, S. The diagnosis and classification of undifferentiated connective tissue diseases. J. Autoimmun. (2014) doi:10.1016/j.jaut.2014.01.019.
- Aringer, M. et al. 2019 European League Against Rheumatism/American College of Rheumatology Classification Criteria for Systemic Lupus Erythematosus. Arthritis Rheumatol. (2019) doi:10.1002/art.40930.
- van den Hoogen, F. et al. 2013 classification criteria for systemic sclerosis: An american college of rheumatology/European league against rheumatism collaborative initiative. Arthritis Rheum. 72, 1747–1755 (2013).
- Shiboski, C. H. et al. 2016 Classification Criteria for primary Sjögren’s Syndrome: A Consensus and Data-Driven Methodology Involving Three International Patient Cohorts. Accept. Publ. Ann. Rheum. Dis. Arthritis Rheum. 69, 35–45 (2016).
- Selva-O’Callaghan, A. et al. Classification and management of adult inflammatory myopathies. Lancet Neurol. 17, 816–828 (2018).
- Ortega-Hernandez, O. D. & Shoenfeld, Y. Mixed connective tissue disease: An overview of clinical manifestations, diagnosis and treatment. Best Pract. Res. Clin. Rheumatol. 26, 61–72 (2012).
- Salaffi, F. et al. High-resolution computed tomography of the lung in patients with rheumatoid arthritis: Prevalence of interstitial lung disease involvement and determinants of abnormalities. Med. (United States) 98, (2019).
- Bouros, D., Papiris, S. & Cottin, V. Lung Involvement in Rheumatic Disease: Introduction. Respiration 90, 1 (2015).
- F.V., C. & J., V. Interstitial lung disease in connective tissue diseases: Evolving concepts of pathogenesis and management. Arthritis Res. Ther. 12, 1–11 (2010).
- Thakkar, V. & Lau, E. M. T. Connective tissue disease-related pulmonary arterial hypertension. Best Pract. Res. Clin. Rheumatol. 30, 22–38 (2016).
- Fischer, A. & Du Bois, R. Interstitial lung disease in connective tissue disorders. Lancet 380, 689–698 (2012).
- Fernandes, L., Nasser, M., Ahmad, K. & Cottin, V. Interstitial Pneumonia With Autoimmune Features (IPAF). Front. Med. 6, 1–10 (2019).
- Myers, J. L. Reprint of: Nonspecific interstitial pneumonia: pathologic features and clinical implications. Semin. Diagn. Pathol. 35, 334–338 (2018).
- Travis, W. D. et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am. J. Respir. Crit. Care Med. 188, 733–748 (2013).
- Wells, A. U. & Denton, C. P. Interstitial lung disease in connective tissue disease – Mechanisms and management. Nat. Rev. Rheumatol. 10, 728–739 (2014).
- McLean-Tooke, A., Moore, I. & Lake, F. Idiopathic and immune-related pulmonary fibrosis: diagnostic and therapeutic challenges. Clin. Transl. Immunol. 8, 1–15 (2019).
- Ciancio, N. et al. Contribution of pulmonary function tests (PFTs) to the diagnosis and follow up of connective tissue diseases. Multidiscip. Respir. Med. 14, 1–11 (2019).
- Bernstein, E. J., Khanna, D. & Lederer, D. J. Screening High-Resolution Computed Tomography of the Chest to Detect Interstitial Lung Disease in Systemic Sclerosis: A Global Survey of Rheumatologists. Arthritis Rheumatol. 70, 971–972 (2018).
- Dorne, H. L. Differentiation of pulmonary parenchymal consolidation from pleural disease using the sonographic fluid bronchogram. Radiology (1986) doi:10.1148/radiology.158.1.3510027.
- Lichtenstein, D., Mézière, G., Biderman, P., Gepner, A. & Barré, O. The comet-tail artifact: An ultrasound sign of alveolar-interstitial syndrome. Am. J. Respir. Crit. Care Med. (1997) doi:10.1164/ajrccm.156.5.96-07096.
- Targhetta, R. et al. Sonographic approach to diagnosing pulmonary consolidation. J. Ultrasound Med. (1992) doi:10.7863/jum.1992.11.12.667.
- Soldati, G., Copetti, R. & Sher, S. Sonographic interstitial syndrome the sound of lung water. J. Ultrasound Med. (2009) doi:10.7863/jum.2009.28.2.163.
- Soldati, G., Sher, S. & Testa, A. Lung and ultrasound: Time to ‘reflect’. European Review for Medical and Pharmacological Sciences (2011).
- Gargani, L. et al. Ultrasound lung comets in systemic sclerosis: a chest sonography hallmark of pulmonary interstitial fibrosis. Rheumatology (Oxford). (2009) doi:10.1093/rheumatology/kep263.
- Warrick, J. H., Bhalla, M., Schabel, S. I. & Silver, R. M. High resolution computed tomography in early scleroderma lung disease. J. Rheumatol. (1991).
- Sedie, A. D. et al. Ultrasound lung comets in systemic sclerosis: A useful tool to detect lung interstitial fibrosis. Clinical and Experimental Rheumatology (2010).
- Tardella, M. et al. Ultrasound in the assessment of pulmonary fibrosis in connective tissue disorders: Correlation with high-resolution computed tomography. J. Rheumatol. 39, 1641–1647 (2012).
- Gutierrez, M. et al. Utility of a simplified ultrasound assessment to assess interstitial pulmonary fibrosis in connective tissue disorders – preliminary results. Arthritis Res. Ther. 13, (2011).
- Moazedi-Fuerst, F. C. et al. Pulmonary echography in systemic sclerosis. Clin. Rheumatol. (2012) doi:10.1007/s10067-012-2055-8.
- Barskova, T. et al. Lung ultrasound for the screening of interstitial lung disease in very early systemic sclerosis. Ann. Rheum. Dis. 72, 390–395 (2013).
- Mohammadi, A., Oshnoei, S. & Ghasemi-Rad, M. Comparison of a new, modified lung ultrasonography technique with high-resolution CT in the diagnosis of the alveolo-interstitial syndrome of systemic scleroderma. Med. Ultrason. (2014) doi:10.11152/mu.2014.2066.161.am1so2.
- Sperandeo, M. et al. Ultrasound signs of pulmonary fibrosis in systemic sclerosis as timely indicators for chest computed tomography. Scand. J. Rheumatol. (2015) doi:10.3109/03009742.2015.1011228.
- Buda, N., Piskunowicz, M., Porzezińska, M., Kosiak, W. & Zdrojewski, Z. Lung Ultrasonography in the Evaluation of Interstitial Lung Disease in Systemic Connective Tissue Diseases: Criteria and Severity of Pulmonary Fibrosis – Analysis of 52 Patients. Ultraschall der Medizin (2016) doi:10.1055/s-0041-110590.
- Gigante, A. et al. Lung ultrasound in systemic sclerosis: correlation with high-resolution computed tomography, pulmonary function tests and clinical variables of disease. Intern. Emerg. Med. (2016) doi:10.1007/s11739-015-1329-y.
- Çakir Edis, E. et al. Effectiveness of thoracic ultrasonography in the evaluation of the severity of pulmonary involvement in patients with systemic sclerosis. Arch. Rheumatol. (2016) doi:10.5606/ArchRheumatol.2016.5849.
- Tardella, M. et al. Ultrasound B-lines in the evaluation of interstitial lung disease in patients with systemic sclerosis. Med. (United States) 97, (2018).
- Hassan, R. I. et al. Lung Ultrasound as a Screening Method for Interstitial Lung Disease in Patients with Systemic Sclerosis. in Journal of Clinical Rheumatology (2019). doi:10.1097/RHU.0000000000000860.
- Aghdashi, M., Broofeh, B. & Mohammadi, A. Diagnostic performances of high resolution trans-thoracic lung ultrasonography in pulmonary alveoli-interstitial involvement of rheumatoid lung disease. Int. J. Clin. Exp. Med. (2013).
- Cogliati, C. et al. Standard and pocket-Size lung ultrasound devices can detect interstitial lung disease in rheumatoid arthritis patients. Rheumatol. (United Kingdom) (2014) doi:10.1093/rheumatology/keu033.
- Hasan, A. A. & Makhlouf, H. A. B-lines: Transthoracic chest ultrasound signs useful in assessment of interstitial lung diseases. Ann. Thorac. Med. (2014) doi:10.4103/1817-1737.128856.
- Moazedi-Fuerst, F. C. et al. Ultrasound screening for interstitial lung disease in rheumatoid arthritis. Clin. Exp. Rheumatol. 32, 199–203 (2014).
- Moazedi-Fuerst, F. C. et al. Sonographic assessment of interstitial lung disease in patients with rheumatoid arthritis, systemic sclerosis and systemic lupus erythematosus. Clin. Exp. Rheumatol. (2015) doi:10.1055/s-0030-1266980.
- Pinal-Fernandez, I. et al. Pleural irregularity, a new ultrasound sign for the study of interstitial lung disease in systemic sclerosis and antisynthetase syndrome. Clin. Exp. Rheumatol. 33, 136–141 (2015).
- Vasco, P. G. et al. Assessment of interstitial lung disease in Sjögren’s syndrome by lung ultrasound: a pilot study of correlation with high-resolution chest tomography. Intern. Emerg. Med. (2017) doi:10.1007/s11739-016-1582-8.
- Gutiérrez, J. et al. OP0141 Ultrasound diagnostic and predictive value of interstitial lung disease in systemic sclerosis.diagnostic and predictive value of ultrasound in the assessment of interstitial lung disease. in (2018). doi:10.1136/annrheumdis-2018-eular.6790.
- Cappelli, S. et al. Interstitial lung disease in systemic sclerosis: Where do we stand? European Respiratory Review (2015) doi:10.1183/16000617.00002915.
