L’IMAGING DELLE SINDROMI DOLOROSE DEL RACHIDE CERVICALE
AUTORI:
1Fausto Salaffi,2Marina Carotti,2Francesco Sessa,1Marco Di Carlo,3Nazarena Malavolta,2Gabriele Polonara,2Andrea Giovagnoni
1Clinica Reumatologica, Ospedale “Carlo Urbani”, Dipartimento Di Scienze Cliniche e Molecolari, Università Politecnica delle Marche, Ancona
2Dipartimento di Scienze Radiologiche, Ospedali Riuniti. Università Politecnica delle Marche, Ancona
3Dipartimento Cardio-Toraco-Vascolare, Programma Dipartimentale: Gestione delle Malattie Reumatiche, del Connettivo e Malattie Metaboliche dell’osso, Policlinico S. Orsola-Malpighi, Bologna
Introduzione
Il coinvolgimento del rachide cervicale nelle malattie muscoloscheletriche rappresenta un elemento prognosticamente sfavorevole in termini di severità di malattia e di mortalità. Tra le malattie infiammatorie, l’artrite reumatoide (AR) colpisce la colonna cervicale in oltre il 25% dei pazienti, già nelle fasi di esordio (Carotti M, et al. Skeletal Radiol 2019; Zoli A, et al. J Rheumatol 2000). L’instabilità atlo-epistrofica può portare a complicazioni neurologiche e a segni di insufficienza vertebro-basilare (Bundschuh C, et al. AJR Am J Roentgenol 1988). L’interessamento della porzione atlo-epistrofica è stato segnalato nel 6,8%-21% dei pazienti con spondiloartrite (SpA). Sebbene sia considerata una forma di artrite degenerativa, anche l’iperostosi scheletrica idiopatica diffusa (D.I.S.H) è comunemente associata ad infiammazione e calcificazione dei tendini o dei legamenti alle entesi, specialmente nella regione della colonna cervicale. L’ossificazione e la calcificazione di queste strutture para e prevertebrali è responsabile del caratteristico aspetto all’esame radiografico. Il coinvolgimento della colonna cervicale, nella D.I.S.H è causa riconosciuta di numerose manifestazioni cliniche, che coinvolgono faringe, laringe ed esofago. Essa condivide caratteristiche radiologiche con la spondilite anchilosante (SA), compresa la tendenza all’ossificazione dei legamenti e delle entesi. La colonna cervicale può essere specificamente coinvolta nelle artropatie associate a deposito di microcristalli, specie in corso di malattia da pirofosfato diidrato di calcio, di malattia da idrossiapatite e da urato monosodico (gotta). Le infezioni spinali, specialmente quelle a carico del tratto cervicale, sono malattie infrequenti e rappresentano il 3-4% di tutte le infezioni spinali. E’ noto che la loro incidenza e complessità sono aumentate a causa di diversi fattori, tra cui un mutamento nelle caratteristiche epidemiologiche dei pazienti colpiti (invecchiamento della popolazione, condizioni di immunosoppressione, comorbilità, ecc.). La tubercolosi, con localizzazione a livello della colonna cervicale è rara (circa lo 0,3% dei casi). La tomografia computerizzata (TC) e la risonanza magnetica (RM) possono contribuire ad una accurata definizione diagnostica di queste entità.
Il coinvolgimento del tratto cervicale in corso di artrite reumatoide
L’ AR è la più frequente malattia infiammatoria cronica che colpisce lo 0,5% della popolazione (Salaffi F, et al. Clin Exp Rheumatol 2005). Il rachide cervicale rappresenta la seconda localizzazione articolare più comune in corso di AR. Il coinvolgimento delle vertebre cervicali varia dal 25% all’88% dei pazienti con malattia di lunga durata (Bundschuh C, et al. AJR Am J Roentgenol 1988; Aggarwal A, et al. J Assoc Physicians India 1996; Zikou AK, et al. J Rheumatol 2005; Joaquim AF, et al. Autoimmun Rev 2014; Bogduk N, et al. Ann Rheum Dis 1984). Il dolore al collo, in particolare a livello della giunzione cranio-cervicale, è una delle presentazioni cliniche più comuni. Il processo infiammatorio porta ad una progressiva lassità legamentosa e distruzione delle strutture articolari, con conseguente instabilità e possibile sublussazione della colonna cervicale. Possono essere coinvolte sia la colonna cervicale superiore (C1 e C2, con le articolazioni atlanto-assiale, atlanto-odontoide e atlanto-occipitale), sia la colonna cervicale subassiale (Joaquim AF, et al. Autoimmun Rev 2014). Considerando l’instabilità atlanto-assiale, la sublussazione atlanto-assiale anteriore (AAS) è la lesione più comune (36%), seguita dall’AAS laterale, che rappresenta circa il 20% dei casi e dall’AAS posteriore, evidenziabile in circa il 7% di tutti i casi di AAS, in pazienti con AR (Bogduk N, et al. Ann Rheum Dis 1984). L’AAS anteriore viene diagnosticata quando l’intervallo atlanto-odontoideo anteriore (AADI), misurato dalla faccia posteriore dell’arco anteriore di C1 e la faccia anteriore del dente dell’epistrofeo è >3 mm. (Figura 1).
Figura 1. La sublussazione atlanto-assiale anteriore (AAS) viene diagnosticata quando l’intervallo atlanto-odontoideo anteriore (AADI), misurato dalla faccia posteriore dell’arco anteriore di C1 al margine anteriore del dente dell’epistrofeo, è >3 mm.
L’AAS posteriore è presente quando la distanza fra il margine posteriore del dente dell’epistrofeo e la faccia anteriore dell’arco posteriore dell’atlante (PADI) è < 14 mm. Un valore inferiore a 14 mm è suggestivo per la presenza di una stenosi del canale atlanto-assiale e rappresenta un valido criterio di impegno neurologico irreversibile. In alcuni casi, l’instabilità atlanto-assiale può portare alla migrazione verticale del processo odontoideo nella cavità cranica (nota anche come impressione o invaginazione basilare, sublussazione verticale, impatto atlanto-assiale o migrazione superiore dell’odontoide) (Joaquim AF, et al. Autoimmun Rev 2014; Pellici PM, et al. J Bone Joint Surg Am 1981). La sublussazione verticale è definita come una migrazione del processo odontoideo > 4.5 mm sopra la linea di McGregor (Reiter MF, et al. Spine J 1998). La linea di McGregor viene tracciata dal margine postero-inferiore del palato duro al punto più caudale dell’osso occipitale (Figura 2), nel radiogramma in proiezione latero-laterale.
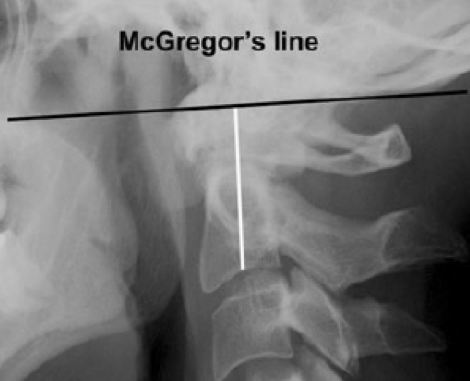
Figura 2. La sublussazione verticale è definita come una migrazione del processo odontoideo > 4.5 mm sopra la linea di Mc Gregor.
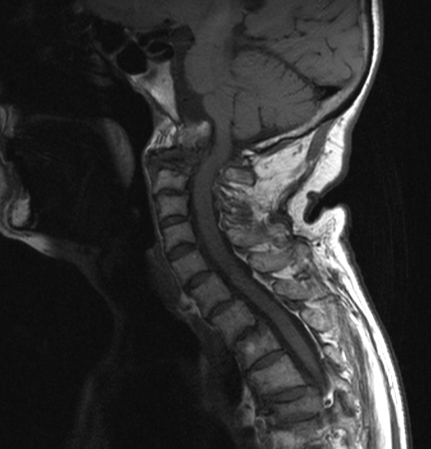
L’affidabilità di questi criteri radiografici nell’identificare i pazienti a rischio di sviluppare un deficit neurologico, resta, tuttavia, controversa (Scott DL, et al. Ann Rheum Dis 1986; Jansen LMA, et al. Ann Rheum Dis 2001). Solo una minoranza di questo sottogruppo di pazienti sviluppa complicazioni neurologiche, compresi i sintomi mielopatici (Fujiwara K, et al. J Spinal Disord 2000; Sunahara N, et al. Spine 1997). Quando è presente la migrazione verticale con compressione midollare, possono comparire segni clinici e sintomi, quali disartria, disfonia, disfagia, diplopia, intorpidimento facciale (paralisi dei nervi cranici), apnea notturna e segni di interessamento del midollo allungato. Una compressione severa del midollo allungato può causare insufficienza vascolare, che porta a vertigini e sincope (Casey AT, et al. J Neurosurg 1997). In una minoranza di pazienti, la migrazione vertebrale, può comportare la morte improvvisa (Reichel H, et al. Z Rheumatol 2002). La principale limitazione dell’esame radiografico convenzionale è rappresentata dalla possibilità di visualizzare solo le strutture ossee e non i tessuti molli ed in particolare il panno sinoviale periodontoideo. Pertanto, in pazienti con esame radiografico negativo, ma con sintomi clinici suggestivi di instabilità cervicale o con deficit neurologici, è indicata l’esecuzione di un esame di RM, che consente la visualizzazione del panno sinoviale, la riduzione dello spazio retro-odontoideo, e conseguentemente la compressione midollare. Tale metodica di imaging rappresenta la tecnica “gold standard” in termini diagnostici e prognostici (Carotti M, et al. Skeletal Radiol 2019; Bundschuh C, et al. AJR Am J Roentgenol 1988) (Figura 3).
 A
A 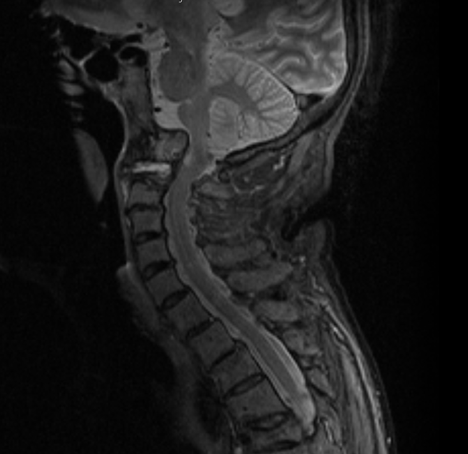 B
B
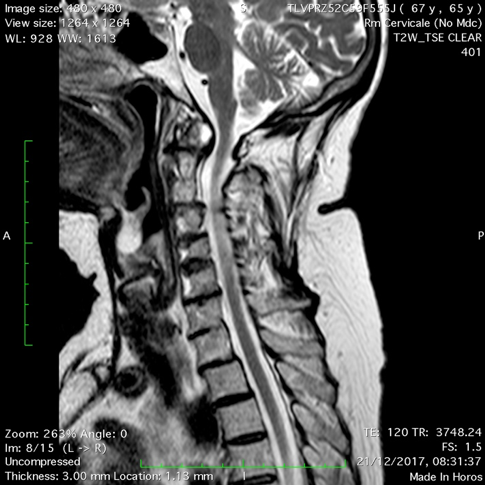
Figura 3. Artrite reumatoide. RM. Le sequenze T1 (a) e T2 pesata (b), in sezione sagittale mostrano multiple erosioni a carico del dente dell’epistrofeo, con conseguente frattura patologica. Panno sinoviale periodontoideo. La porzione di dente fratturato è risalita oltre il forame magnum e si è spostato posteriormente nel canale vertebrale comprimendo la giunzione bulbo-midollare.
L’elevata sensibilità della RM, integrata con l’utilizzo del mezzo di contrasto (m.d.c) paramagnetico, consente la diagnosi precoce del coinvolgimento del rachide cervicale, prima che si instauri il danno strutturale irreversibile (Figura 4).
 A
A 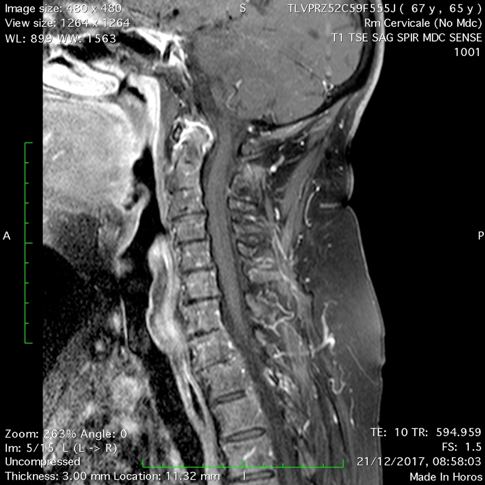 B
B
Figura 4. Artrite reumatoide. RM. La sequenza T2 pesata (a) e T1 con mezzo di contrasto (b) in sezione sagittale mostrano ispessimento dei tessuti molli periodontoidei , con elevato enhancement contrastografico dopo mdc in relazione a flogosi attiva. Il processo odontoideo appare eroso ed edematoso. L’iniziale migrazione verticale del processo odontoideo provoca la compressione della giunzione cervico-midollare.
Bundschuh et al. (3) hanno descritto l’angolo cervico-midollare come l’angolo compreso tra due linee tracciate rispettivamente lungo il margine anteriore del midollo allungato e il margine anteriore del midollo spinale. In condizioni normali tale angolo è compreso tra 135° e 175°. I pazienti con un angolo cervico-midollare inferiore a 135° presentavano segni clinici di dolore al collo, a livello della radice di C2, compressione neurale o mielopatia. La TC può contribuire a fornire informazioni dettagliate sull’interessamento osseo ed ha dimostrato una evidente correlazione con i deficit neurologici rispetto alla valutazione dell’AADI.
In corso di AR sono stati identificati diversi potenziali fattori di rischio di progressione della malattia a livello cervicale. Questi possono essere suddivisi in fattori di rischio non radiografici e radiografici. I primi, includono il sesso maschile, la positività del fattore reumatoide (RF) e la presenza di anticorpi proteici anti-citrullinati (ACPA), la coesistenza di noduli reumatoidi, la presenza di lesioni a carattere erosivo, il persistente incremento dei reattanti della fase acuta (specie la proteina C-reattiva), una lunga durata di malattia e l’uso prolungato di corticosteroidi (Neva MH, et al. Arthritis Rheum 2003; Paimela L, et al. J Rheumatol 1997; Reichel H, et al. Z Rheumatol 2002). La positività degli ACPA, l’elevata e persistente attività di malattia e la precoce comparsa di erosioni articolari sono considerati parametri prognosticamente sfvorevoli anche nell’AR ad esordio recente (ERA) (Carotti M, et al. Skeletal Radiol 2019; Zoli A, et al. J Rheumatol 2000; Scott DL, et al. Rheumatology (Oxford) 2000; Lindqvist E, et al. Ann Rheum Dis 2002). La documentata relazione fra la malattia erosiva periferica ed il coinvolgimento cervicale (Neva MH, et al. Arthritis Rheum 2003; Ahn JK, et al. Rheumatol Int 2011) rafforza la teoria dell’influenza primaria della sinovite, come già dimostrato durante le fasi iniziali del processo flogistico a carico delle mani e dei piedi (Conaghan PG, et al. Arthritis Rheum 2003; McQueen FM, et al. Arthritis Rheum 2003). Per tale ragione, trova indicazione lo studio in RM della colonna cervicale per ogni paziente con ERA attiva, sieropositiva per ACPA e con caratteri di erosività (Schwarz-Eywill M, et al. Dtsch Med Wochenschr 2005; Magarelli N, et al. Radiol Med 2010).
Il coinvolgimento del tratto cervicale in corso nelle spondiloartriti
Il termine di spondiloartriti sieronegative o SpA è stato introdotto per definire un gruppo di malattie reumatiche infiammatorie ad andamento cronico, classificate tra le affezioni su base immunitaria (Immune-Mediated Infiammatory Disease). Attualmente, le SpA vengono suddivise in sette sottotipi principali: la spondilite anchilosante (SA), l’artrite psoriasica (AP), le spondiloartriti reattive, le spondiloartriti enteropatiche (associate a malattie infiammatorie croniche intestinali, quali la colite ulcerosa e la malattia di Crohn), le spondiloartriti indifferenziate, le spondiloartriti dell’infanzia o giovanili e l’uveite anteriore acuta – HLA-B27 positiva. Le più comuni sono la SA e l’AP. L’artrite reattiva e l’artrite enteropatica hanno una minore prevalenza. La severità di tali patologie è strettamente correlata al grado di attività delle stesse ed alla rapidità con cui si instaura il danno anatomico, con conseguente perdita della mobilità, della funzione fisica e della compromissione della qualità della vita. Le SpA colpiscono principalmente la colonna vertebrale ed è riportato il coinvolgimento della regione superiore del collo. La sublussazione atlanto-assiale anteriore è la manifestazione più frequente (descritta nel 6,8-21% della malattia della colonna vertebrale cervicale), solitamente osservata in pazienti con malattia severa e di lunga durata (Ramos-Remus C, et al. J Rheumatol 1995).
Spondilite anchilosante
La prevalenza globale della SA è dello 0.1%-1.4%. Nell’Europa centrale e occidentale è stimata nell’ordine dello 0.3-0.5% ed in Italia è risultata pari allo 0.37% (Salaffi F, et al. Clin Exp Rheumatol 2005). La SA colpisce maggiormente il sesso maschile rispetto a quello femminile (3:1), di solito in una fascia di età giovanile, compresa tra i 15 e i 30 anni. Il bersaglio dell’infiammazione è rappresentato dalle entesi, ossia la giunzione osteo-tendinea. Dapprima l’infiammazione (entesite) coinvolge il connettivo fibroso con alterazioni necrotiche fibrillari, erosione della corticale ossea ed edema dello spazio midollare adiacente. Successivamente, si sviluppano segni di riparazione con comparsa di tessuto fibroso, metaplasia cartilaginea e proliferazione di tessuto osseo con formazione di ponti ossei (sindesmofiti). La progressione delle lesioni del rachide è ascendente, a partire dalle articolazioni sacroiliache e dal rachide lombare. Anche a livello delle articolazioni sacroiliache, da una fase infiammatoria (sacroileite) si passa alla comparsa di erosioni ossee e quindi all’anchilosi (Hamdi W, et al. Joint Bone Spine. 2012). Nel rachide il processo infiammatorio interessa soprattutto la giunzione disco-vertebrale nel punto in cui l’anulus fibroso si inserisce al corpo vertebrale. Le lesioni iniziali sono rappresentate dallo “squaring” dei corpi vertebrali e l’erosione con la sclerosi (lesione di Romanus) degli spigoli vertebrali. Quest’ultima è seguita dalla proliferazione ossea che porta alla formazione dei sindesmofiti, che uniscono a ponte i corpi vertebrali, che si differenziano dalla proliferazione ossea che interessa il legamento longitudinale anteriore, tipica della iperostosi scheletrica idiopatica diffusa (DISH). I sindesmofiti conferiscono alla colonna vertebrale l’aspetto a “canna di bamboo”. L’interessamento delle articolazioni interapofisarie, costo-vertebrali e costo-trasversarie con il tempo portano all’anchilosi, responsabile della limitata motilità del rachide e della ridotta espansibilità della gabbia toracica. Il rischio di sviluppare un interessamento del rachide cervicale nella SA è strettamente correlato alla durata della malattia: il 19.6% manifesta un coinvolgimento cervicale dopo 5 anni dall’esordio; il 29.9% dopo 10 anni ed il 45.1% dopo 20 anni. La compromissione della cerniera atlo-epistrofica è particolarmente frequente (14.1%) nelle fasi tardive della malattia. L’instabilità atlanto-assiale (AAI) e, più raramente, la formazione di panno peri-odontoideo, simile a quello osservato in corso di AR, può portare alla distruzione di legamenti, delle strutture osteo-cartilaginee, che in alcuni casi si traduce in una instabilità atlanto-assiale e in complicazioni neurologiche, raramente fatali. Le manifestazioni cliniche più frequenti sono il dolore al collo, la rigidità e la compromissione della mobilità attiva e passiva (Slobodin G, et al. Eur Spine J 2015). Circa il 40-50% dei pazienti con SA presenta alterazioni radiologiche nella colonna vertebrale cervicale (Slobodin G, et al. Eur Spine J 2015El Maghraoui A, et al. Clin Rheumatol 2003). La lesione più comunemente osservata è lo “squaring” vertebrale, seguita dalla formazione di sindesmofiti, di erosioni del corpo vertebrale e disciti (El Maghraoui A, et al. Clin Rheumatol 2003). L’entesopatia cranio-cervicale in pazienti con SA merita particolare attenzione. I pazienti con AS mostrano un maggior coinvolgimento, rispetto ai controlli, del legamento trasverso, che ha una componente sinoviale. La dislocazione, la fusione delle articolazioni zigapofisarie, l’ossificazione secondaria atlanto-occipitale e la stenosi del canale spinale possono anche essere considerati come parte del processo patologico. L’ossificazione paraspinale diffusa e l’osteite infiammatoria rendono il rachide cervicale rigido e fragile, a rischio di fratture, anche a seguito di piccoli traumi (Liu J, et al. World Neurosurg 2019; Benmansour A et al. Rachis 1996). La sublussazione e la discite che coinvolgono la colonna cervicale possono portare a gravi manifestazioni neurologiche (El Maghraoui A, et al. Clin Rheumatol 2003; Liu J, et al. World Neurosurg 2019; Benmansour A et al. Rachis 1996).
Artrite psoriasica
L’AP è una malattia infiammatoria articolare cronica che si associa con la psoriasi, classificata tra le SpA. L’AP può manifestarsi ad ogni età. Il picco d’incidenza massimo è compreso tra i 20 e i 40 anni. La prevalenza dell’AP, tra i pazienti con psoriasi, è di circa il 5-8% e, nella popolazione generale, è stimata nell’ordine dello 0.4-1% (Salaffi F, et al. Clin Exp Rheumatol 2005). I due sessi sono colpiti in egual misura (negli uomini è più frequente l’interessamento dello scheletro assiale) (Salaffi F, et al. Clin Exp Rheumatol 2005). Il coinvolgimento della colonna vertebrale cervicale è stato riportato nel 35-75% dei pazienti con AP. Il quadro clinico è caratterizzato da anchilosi ed ossificazione dei legamenti nell’85% dei pazienti (Chandran V, et al. J Rheumatol2009; Blau RH, et al. J Rheumatol 1987) (Figura 5).
 A
A 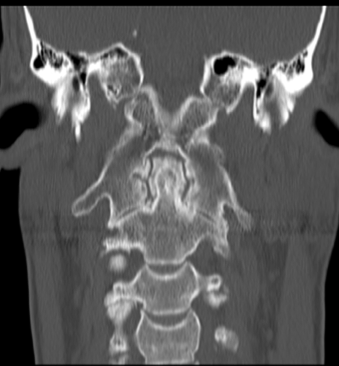 B
B 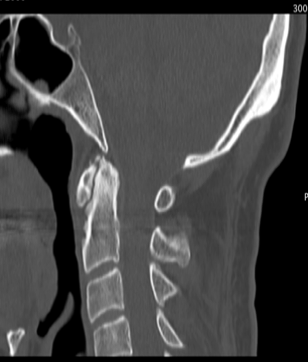 C
C
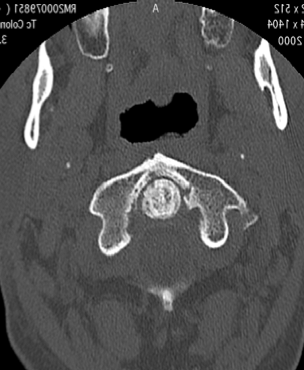
Figura 5. Artrite psoriasica: (a) Le immagini TC assiale, (b) coronale e (c) sagittale mostrano una marcata riduzione dello spessore delle rime articolari C1-C2 con aree di sclerosi ed erosioni subcondrali più evidenti a sinistra nella porzione mediale peri-odontoidea. All’apice del processo odontoideo si osservano microerosioni ossee subcondrali. Fusione completa delle articolazioni atlanto-occipitali. Reazione periostale estesa e irregolare (entesopatia) che coinvolge le inserzioni del legamento cranio-cervicale che circondano il processo odontoideo.
Le alterazioni infiammatorie della colonna cervicale in corso di AP possono essere meno comuni e severe di quelle documentate in corso di AR, con la possibile eccezione dell’anchilosi articolare apofisaria (Neva MH, et al. Arthritis Rheum 2003). Contrariamente a quanto avviene nella SA, nell’AP la spondilite è spesso asimmetrica ed i sindesmofiti sono più grossolani (vengono definiti sindesmofiti non marginali), in quanto non originano dallo spigolo, bensì dal corpo vertebrale. Laiho et al. hanno osservato la presenza di alterazioni infiammatorie a carico del rachide cervicale nelle radiografie della colonna cervicale nel 18% dei pazienti con AP (Laiho K, et al. Ann Rheum Dis 2002). Jeannou et al. hanno dimostrato, in radiologia convenzionale, che le anomalie delle faccette articolari (osteofiti, perdita di spazio articolare, sclerosi) in particolare a livello di C3-C4 e di C4-C5, erano significativamente più comuni nei pazienti con AP (Jeannou J, et al. Rev Rhum Engl Ed 1999). Jenkinson et al. hanno documentato un coinvolgimento della colonna vertebrale cervicale nel 36%-45% dei casi (Jenkinson T, et al. Br J Rheumatol 1994). Bobek et al. hanno trovato un’incidenza del 68% di coinvolgimento del rachide cervicale in pazienti con AP con malattia sintomatica in tale sede, e nel 29% di questi pazienti erano presenti manifestazioni radiologiche di coinvolgimento infiammatorio (Bobek D, et al. Reumatizam 2007). In corso di AP, i fattori associati al coinvolgimento della colonna cervicale includevano una durata di malattia più lunga, una flogosi attiva durante i primi 5 anni e la coesistenza di un’artrite periferica (Salvarani C, et al. Ann Rheum Dis 1992). La spondilite cervicale non è risultata correlata all’entità del coinvolgimento psoriasico cutaneo o ungueale (Jenkinson T, et al. Br J Rheumatol 1994).
Il coinvolgimento del tratto cervicale nella Iperostosi Scheletrica Idiopatica Diffusa (DISH)
La DISH è una condizione sistemica, non infiammatoria, relativamente comune, con una prevalenza media di circa il 10% nelle persone di età superiore ai 50 anni (Mader R, et al. RMD Open 2017; Kagotani R, et al. J Bone Miner Metab 2015; Hiyama A, et al. BMC Musculoskelet Disord 2018). Oltre il cinquantesimo anno di età si evidenzia nel 27.3% degli individui di sesso maschile e nel 12.8% degli individui di sesso femminile; oltre i 75 anni tali percentuali salgono al 36.1% ed al 25.9%, rispettivamente. Il segno distintivo di questa malattia è rappresentato dall’ossificazione dei legamenti e delle entesi a carico delle regioni prevertebrali e prediscali della colonna vertebrale (Carotti M, et al. Skeletal Radiol 2019; Resnick D, et al. Radiology 1976). Per entesi si intendono le sedi di inserzioni delle fibre dei legamenti intrinseci ed estrinseci, delle strutture mio-tendinee, delle capsule fibrose articolari, degli anelli fibrosi dei dischi intervertebrali, di retinacoli, di aponeurosi e di fasce muscolari ed interossee. La calcificazione iperostotica interessa tipicamente i legamenti anterolaterali delle vertebre toraciche, ma possono essere coinvolte anche le vertebre cervicali (Figura 6) e quelle lombari (Figura 7).
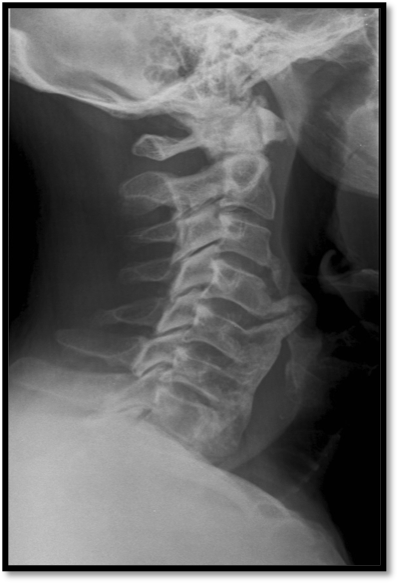
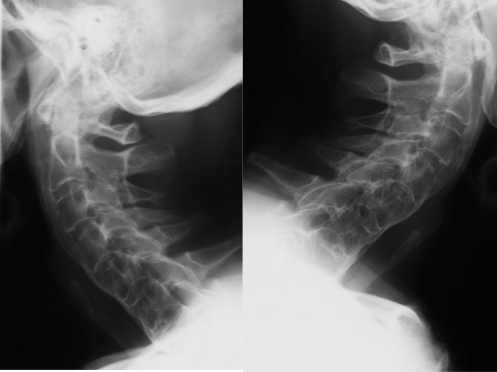
Figura 6. L’esame radiografico del rachide cervicale in proiezione latero-laterale evidenzia una grossolana ossificazione del legamento longitudinale anteriore da C4 a C6, con fusione anteriore.
Attualmente, l’imaging è il metodo più comunemente impiegato per diagnosticare la D.I.S.H. Le lesioni anatomo-patologiche della D.I.S.H. vengono classicamente distinte in due tipi, quelle del I tipo più tipiche del tratto cervicale e quelle del II tipo del tratto dorso-lombare:
– Le alterazioni del I tipo coinvolgono i legamenti. La più frequente è l’ossificazione del legamento longitudinale anteriore del rachide (LLA), che inizia con una calcificazione “ispida” disposta lungo la porzione legamentosa che ricopre il terzo mediale della superficie antero-laterale dei corpi vertebrali, punto da cui poi origina il processo entesopatico ossificante. Un reperto radiologico tipico è rappresentato dallo spazio radiotrasparente che può essere osservato sui radiogrammi in proiezione laterale fra il margine anteriore dei corpi vertebrali ed il ligamento longitudinale ossificato antistante. È anche possibile che precocemente si formi una calcificazione tra il LLA e le strutture periferiche del disco intervertebrale. Questi piccoli nuclei di ossificazione rendono ragione delle immagini radiografiche descritte come “ossificazioni paravertebrali”, che poi si estendono e si allargano interessando gli strati più interni del LLA. E’ stata anche riportata l’ossificazione del legamento longitudinale posteriore (LLP), specialmente in individui nella VII decade di vita; tale localizzazione risulta sintomatica in circa l’85% dei casi. Più rara risulta l’ossificazione dei legamenti dell’arco vertebrale.
– Le alterazioni di tipo II avvengono primariamente a carico del disco intervertebrale, il cui materiale protrude marginalmente, determinando un “effetto ombrello”, trascinando con sé le fibre del LLA. Tale meccanismo patogenetico, del tutto analogo a quello riscontrato in corso di spondilosi deformante, sembrerebbe riconoscere come “primum movens” una particolare degenerazione delle fibre di Sharpey (Forestier J, et al. Clin Orthop Relat Res 1971). Anche nelle articolazioni extra-rachidee l’elemento anatomo-patologico più caratteristico è l’entesopatia ossificante. Le sedi più tipicamente interessate sono il grande trocantere, il calcagno, l’olecrano ed il ginocchio, in particolare il margine rotuleo anteriore, strutture sulle quali agiscono con maggiore intensità i microtraumi ripetitivi. La classificazione più comunemente usata per la D.I.S.H è stata proposta da Resnick e Niwayama (Resnick D, et al. Radiology 1976). Sono stati definiti pazienti con D.I.S.H, i soggetti che manifestavano le seguenti alterazioni radiologiche: presenza di calcificazioni ed ossificazioni lungo la superficie anterolaterale di almeno quattro corpi vertebrali contigui, con o senza associate proliferazioni ossee nel tratto di passaggio tra disco e corpo; conservazione dell’altezza del corpo vertebrale nell’area coinvolta; assenza di segni radiografici di patologie degenerative a carico dei dischi intervertebrali; assenza di anchilosi ossea nelle giunzioni apofisarie ed erosione, sclerosi o fusione ossea a livello dell’articolazione sacro-iliaca (Resnick D, et al. Radiology 1976).
Nel 1985, Utsinger ha ampliato ulteriormente i criteri di classificazione per includere le entesopatie periferiche (Utsinger PD, Clin Rheum 1985; Leibushor N, et al. AJR Am J Roentgenol 2017). L’interessamento extra-vertebrale della D.I.S.H è ugualmente caratteristico della malattia tanto da poter consentire la diagnosi anche in assenza dell’interessamento del rachide (Tabella 1).
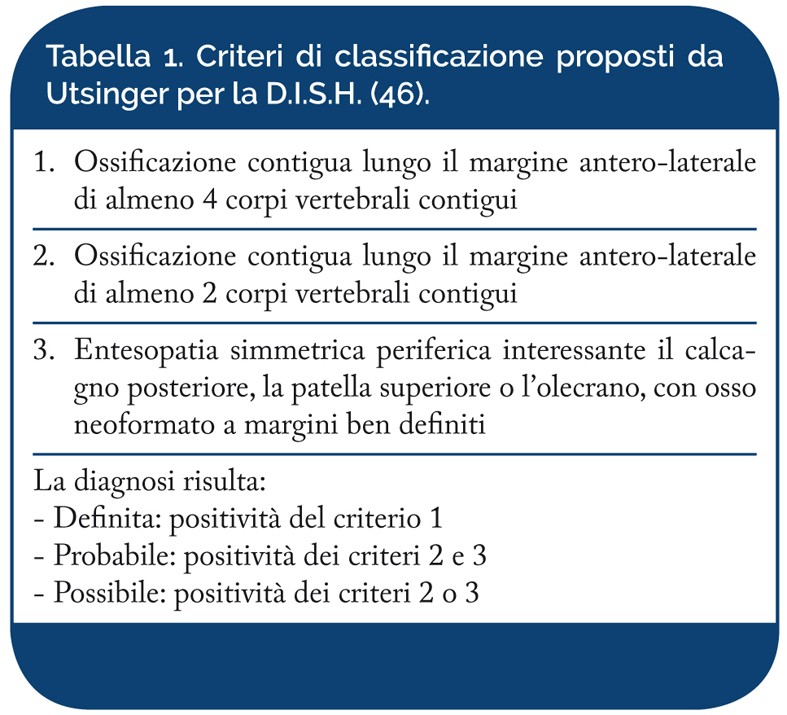
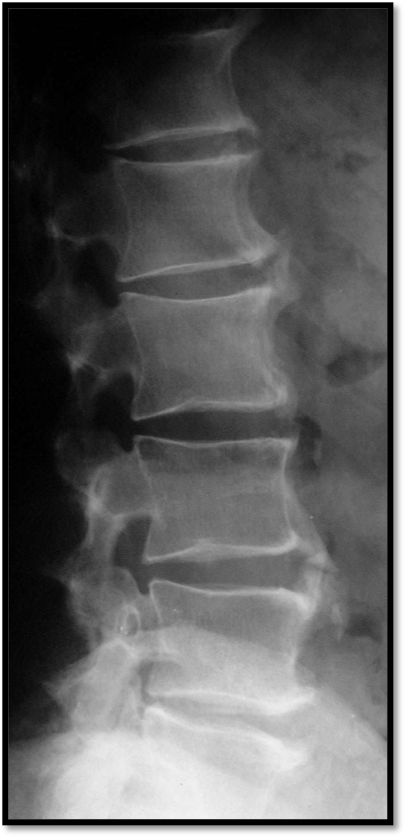
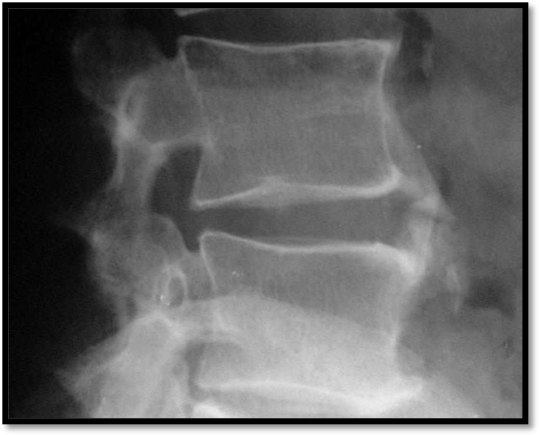
Figura 7. D.I.S.H – La radiografia del rachide lombare in proiezione latero-laterale evidenzia neoformazione ossea non marginale, separata dal bordo del corpo vertebrale e del disco intervertebrale, con evidenza di spazio radiotrasparente.
La TC si è dimostrata più sensibile rispetto alla radiologia convenzionale nella valutazione delle alterazioni osteostrutturali nella D.I.S.H, (Slonimsky E, et al. Clin Rheumatol 2016) (Figura 8).
 A
A 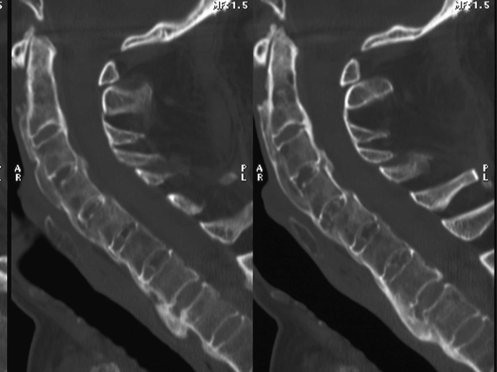 B
B
Figura 8. L’esame radiografico in proiezione laterale (a) e la ricostruzione multiplanare sul piano sagittale della TC del rachide cervicale (b) mostrano estesa ossificazione delle strutture legamentose paravertebrali anteriori, con particolare interessamento del legamento longitudinale anteriore.
La D.I.S.H e la SA sono malattie diverse che hanno in comune l’interessamento del rachide e delle entesi periferiche (Tabella 2). Sebbene gli aspetti semeiologici siano differenti, le due malattie sono spesso confuse a causa, soprattutto, dell’insufficiente conoscenza delle caratteristiche radiologiche distintive. E, inoltre, segnalato che la diagnosi differenziale fra la D.I.S.H e la SA non sia confinata ai soli aspetti radiologici, ma si estenda anche alle manifestazioni cliniche. In breve, le principali caratteristiche che distinguono la D.I.S.H dalla SA sono l’età di presentazione più avanzata, l’assenza di lesioni erosive dell’articolazione sacroiliaca, l’assenza di coinvolgimento apofisario, la frequente ossificazione del legamento longitudinale anteriore (OALL) e posteriore (OPLL), l’assenza di entesopatie con erosioni, l’assenza di associazione con HLA-B27. La D.I.S.H presenta, tuttavia, caratteristiche simili alla SA, quali la tendenza all’ossificazione dei legamenti e delle entesi, sebbene in corso di AS questo processo sia sostenuto da differenti meccanismi infiammatori (Olivieri I, et al. Curr Rheumatol Rep 2009) (Tabella 2). Le manifestazioni cliniche più comuni della D.I.S.H sono direttamente correlate agli effetti meccanici sulla colonna vertebrale. Questi includono il dolore spinale ed i sintomi radicolari come il dolore, le parestesie, l’intorpidimento e la debolezza agli arti. Essa può anche presentarsi con una compromissione della mobilità attiva e passiva della colonna vertebrale e la predisposizione allo sviluppo di fratture instabili della colonna stessa (Olivieri I, et al. Curr Rheumatol Rep 2009; Vengust R, et al. Eur Spine J). In merito al campo d’interesse otorinolaringoiatrico, assumono particolare importanza le manifestazioni cliniche derivanti dal coinvolgimento del rachide cervicale, specie la disfagia e la disfonia, con le possibili complicanze di tipo respiratorio, la roncopatia cronica (o russamento cronico patologico) e gli episodi apnoici notturni inquadrabili nella OSAS (Obstructive Sleep Apnea Sindrome) (Gosavi K, et al. Asian J Neurosurg 2018; Varsak YK, et al. J Craniofac Surg 2014). La comparsa di sintomi respiratori e/o fonatori può essere determinata dal verificarsi di diverse condizioni patologiche: ulcerazione ed edema della regione posteriore della cartilagine cricoide; neurite del nervo laringeo ricorrente; condrite della cartilagine cricoide con conseguente coinvolgimento delle aritenoidi e dell’articolazione cricoaritenoidea; congestione e/o irritazione dello spazio prevertebrale, con conseguente edema che si estende all’esofago ed alla regione ari-epiglottica e sottoglottica, derivanti da una severa esostosi della colonna cervicale (Masiero S, et al. Rheumatol Int 2010; Carlson ML, et al. Dysphagia 2011). La disfagia, caratteristicamente più marcata durante l’ingestione di cibi solidi piuttosto che per i liquidi, compare in una percentuale compresa tra il 6% ed il 28% dei pazienti che manifestano osteofiti della colonna cervicale. Rapportando questi dati ai valori d’incidenza totale della DISH, si deduce che la disfagia determinata dal coinvolgimento del rachide cervicale nella D.I.S.H. può interessare la popolazione generale in una percentuale compresa tra lo 0,1% ed il 6% (Giger R, et al. Dysphagia 2006; Verlaan JJ, et al. Spine J 2011). Diversi fattori possono concorrere nel determinismo di tale sintomo in corso di D.I.S.H: presenza di un osteofita di grandi dimensioni che comprime e restringe il lume esofageo; presenza di un osteofita localizzato in corrispondenza di uno dei siti nel quale l’esofago è meno mobile; in particolare a livello del punto in cui è ancorato alla cartilagine cricoide e nel tratto in cui attraversa lo iato diaframmatico; dolore o spasmi esofagei indotti dalla presenza delle alterazioni scheletriche cervicali che compaiono in corso di D.I.S.H; ripetuti movimenti della faringe o dell’esofago lungo gli osteofiti protrudenti, tali da determinare un processo infiammatorio nei tessuti molli circostanti. Nei casi in cui il processo osteofitico interessi il tratto C4-C5 del rachide cervicale può verificarsi aspirazione, prevalentemente di liquidi, per mancata retroversione dell’epiglottide durante la deglutizione. Tale eventualità può determinare, nei soggetti predisposti, una “polmonite ab-ingestis”, talvolta anche a prognosi severa. Inoltre, un osteofita protrudente a livello della cartilagine cricoide può causare l’ulcerazione dell’ipofaringe, con comparsa di odinofagia ed otalgia. La mielopatia associata all’ossificazione del legamento longitudinale posteriore (OPLL) e all’ossificazione del legamento flavum (OLF) è un’altra possibile complicazione, poiché l’OPLL e/o l’OLF sono stati riportati in associazione con la D.I.S.H fino al 50% dei casi (McAfee PC, et al. J Bone Joint Surg Br 1987). La radiografia convenzionale è di solito sufficiente a confermare la diagnosi di D.I.S.H e la videofluoroscopia dinamica, che permette un’analisi dettagliata delle varie fasi deglutitorie, dalla fase orale alla fase esofagea inferiore, mediante l’utilizzo di bolo radiopaco e contemporaneo studio radiografico, dovrebbe essere riservata per dimostrare l’esatta relazione delle alterazioni della colonna cervicale con la funzione di deglutizione nei pazienti con disfagia (Aydin E, et al. Acta Otolaryngol 2006) (Figura 9).
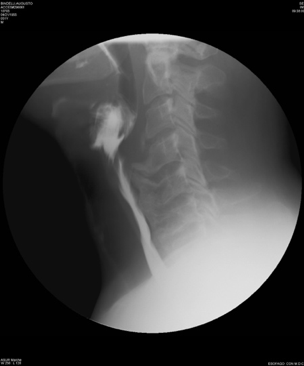
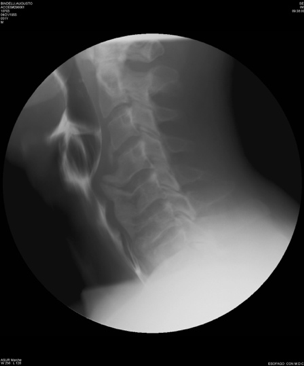
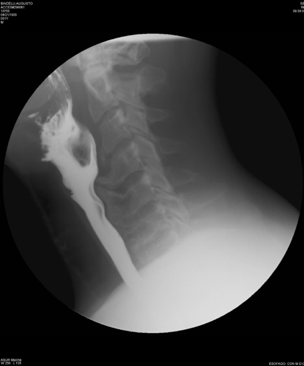
Figura 9. Video-fluoroscopia dinamica in proiezione laterale. L’ossificazione prevertebrale diffusa protrude anteriormente e comprime la parete posteriore della faringe a livello C4-C6.
La TC e la RM possono essere utilizzate per individuare dettagliatamente tali alterazioni (ad esempio la presenza di mielopatia associata a OPLL o OLF) e le complicanze (la come la stenosi del canale spinale e la mielomalacia compressiva o la frattura-dislocazione di elementi anteriori e posteriori) (Cammisa M, et al. Eur J Radiol 1998).
Il coinvolgimento del tratto cervicale nelle artropatie associate a deposito di cristalli
La colonna cervicale può essere specificamente coinvolta nelle artropatie associate a deposito di cristalli. Esse rappresentano un gruppo di malattie metaboliche in cui i cristalli si depositano all’interno ed intorno alle articolazioni, provocando lesioni infiammatorie e distruttive (Feydy A, et al. Eur Radiol 2006). In questa rassegna, l’attenzione è focalizzata sui tre tipologie di cristalli e malattie associate: la malattia da deposizione di pirofosfato diidrato di calcio (CPPD), la malattia da deposizione di cristalli di idrossiapatite (HADD) e la malattia da deposizione di cristalli di urato monosodico (gotta).
La malattia da deposizione di pirofosfato diidrato di calcio (CPPD)
Si tratta di un’artropatia indotta dalla precipitazione dei cristalli di pirofosfato diidrato di calcio, in sede intra e periarticolare ed è la seconda forma più comune della malattia di deposizione dei cristalli che si osserva soprattutto nei pazienti anziani. Tuttavia, a causa della marcata eterogeneità delle sindromi cliniche associate alla CPPD, la sua prevalenza e incidenza sono difficili da definire (Salaffi F, et al. Clin Exp Rheumatol 2005). Anche se la maggior parte dei casi sono idiopatici, vi sono rare forme di CPPD familiari, e la condizione è stata osservata in coincidenza con altri disturbi metabolici. La malattia da deposizione di cristalli di pirofosfato diidrato di calcio è clinicamente associata ad una mono- o oligoartrite episodica acuta, denominata “pseudogotta”, che coinvolge una grande articolazione (solitamente le ginocchia, i polsi o le caviglie) o un’artropatia cronica che si manifesta come lieve dolore articolare e rigidità di ginocchia, polsi, metacarpofalangee, gomiti e spalle (Dieppe PA, et al. Ann Rheum Dis 1982). Meno comunemente, sono stati osservati depositi di pirofosfato diidrato di calcio intorno alle strutture articolari della colonna vertebrale, compresi il disco intervertebrale, il legamento longitudinale posteriore, le faccette articolari, il legamento flavum e le articolazioni sacroiliache (Baba H, et al. Spine 1993). Nella colonna cervicale, i depositi calcifici possono essere asintomatici o essere associati a dolore cervico-occipitale acuto a carattere recidivante, con febbre, rigidità del collo e sindrome biologica da flogosi (Bouvet JP, et al. Arthritis Rheum 1985). Questa entità clinica, chiamata “sindrome del dente incoronato” (CDS), può simulare diverse condizioni cliniche e può essere responsabile di febbre a carattere persistente (Salaffi F, et al. Clin Exp Rheumatol 2008; Aouba A, et al. Rheumatology 2004). La deposizione di cristalli di pirofosfato diidrato di calcio può avvenire a livello di vari tessuti molli, che includono la cartilagine, la capsule articolari, la membrana sinoviale, le borse, i tendini ed i legamenti. Uno dei legamenti frequentemente coinvolti dalla deposizione di cristalli di pirofosfato diidrato di calcio è il legamento trasversale dell’atlante (TLA), che è una spessa e forte banda di fibre di collagene che si inarca dietro il processo odontoideo e mantiene il contatto tra il processo odontoideo e l’arco anteriore di C1. La sua interruzione può comportare una sublussazione atlanto-assiale. La calcificazione osservata a carico del TLA può essere curvilinea, puntiforme o mista (Feydy A, et al. Eur Radiol 2006; Constantin A, et al. Rheum Dis 1996). La ragione del deposito preferenziale di cristalli di pirofosfato diidrato di calcio in questa sede può essere legato alla struttura della cartilagine del TLA. Infatti, il TLA è composto principalmente da fibrocartilagine, come i menischi, la fibrocartilagine triangolare del carpo, e la sinfisi pubica, che sono le sedi più frequenti di depositi di CPPD (Milz S, et al. Spine 2001). Lo spettro clinico della CDS è ampio. Si possono osservare manifestazioni atipiche, come il meningismo (Aouba A, et al. Rheumatology 2004), il dolore cervico-brachiale (con debolezza e rigidità della spalla) e la cefalea occipitale e/o temporale (che evoca il sospetto di una polimialgia reumatica atipica e/o l’arterite a cellule giganti) (Aouba A, et al. Rheumatology 2004). La radiografia convenzionale è utile per la rilevazione della condrocalcinosi nello scheletro appendicolare. La TC è più sensibile e particolarmente utile nella rilevazione della deposizione di cristalli di CPPD adiacenti al processo odontoideo (Feydy A, et al. Eur Radiol 2006; Kakitsubada Y, et al. Radiology 2000). L’indagine TC focalizzata su C1/C2 rappresenta, quindi, la tecnica “gold standard” nella diagnosi di CDS (Figura 10). La TC consente, inoltre, di porre la diagnosi differenziale con altre condizioni, quali le fratture odontoidee non riconosciute o la compressione del cordone cervicale. Sono stati descritti anche massicci depositi di cristalli di CPPD con cisti sub-condrali o erosione ossea che coinvolgono le vertebre cervicali (Kakitsubada Y, et al. Radiology 2000).
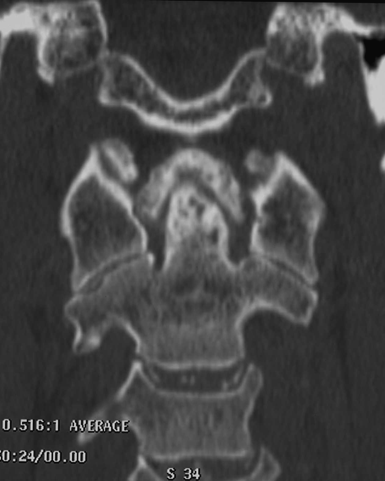
Figura 10. Esame TC del rachide cervicale. La ricostruzione multiplanare sul piano coronale evidenzia depositi calcifici a “ferro di cavallo” periodontoidei e multiple erosioni subcondrali del processo odontoideo, suggestivi per CPPD. Si associa condrocalcinosi del disco intervertebrale, con interessamento sia dell’anulus fibrosus che del nucleo polposo.
Malattia da deposizione di cristalli di idrossiapatite.
La malattia da deposizione di cristalli di idrossiapatite (HADD) è una malattia sistemica ben nota, ad eziologia sconosciuta, causata dalla deposizione para-articolare e/o intra-articolare di cristalli di HA (Garcia GM, et al. Semin Musculoskelet Radiol 2003). L’incidenza reale è poco nota, poiché questa condizione è tuttora sotto diagnosticata (Zibis AH, et al. Eur Spine 2013; Levy Z, et al. West J Emerg Med 2012). E’ più comune nella mezza età, con la stessa distribuzione tra i sessi (Wakabayashi Y, et al. Neurol Med Chir (Tokyo) (2012)). Analogamente alla CPPD è spesso asintomatica e viene rilevata solo incidentalmente attraverso un esame radiografico. Il coinvolgimento cervicale nell’HADD può presentarsi con un quadro clinico fuorviante, rappresentato da dolore acuto al collo, febbre o sintomi neurologici. L’imaging consente una diagnosi accurata nei casi tipici di depositi calcifici e di lesioni distruttive dei dischi e delle articolazioni (Tabella 3) (Feydy A, et al. Eur Radiol 2006). Sono riconosciute tre diverse entità cliniche e radiologiche di HADD a livello cervicale (Feydy A, et al. Eur Radiol 2006; Garcia GM, et al. Semin Musculoskelet Radiol 2003): (i) la tendinite calcifica del muscolo lungo del collo (longus colli); (ii) le calcificazioni che circondano il processo odontoideo (sindrome del dente incoronato); (iii) la calcinosi discale.

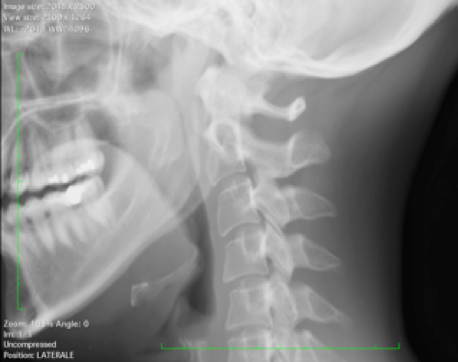
– Tendinite calcifica del muscolo lungo del collo. Questa condizione colpisce gli adulti e la maggior parte dei pazienti ha un’età compresa tra i 30 e i 60 anni. La tendinite calcifica acuta del muscolo lungo del collo, nota anche come tendinite retrofaringea, è una condizione autolimitante che si risolve spontaneamente entro 1 o 2 settimane, dovuta alla deposizione di cristalli amorfi di calcio idrossiapatite nei tendini del muscolo lungo del collo (Feydy A, et al. Eur Radiol 2006; Garcia GM, et al. Semin Musculoskelet Radiol 2003; Zibis AH, et al. Eur Spine 2013). All’imaging le caratteristiche patognomoniche consistono nella densità calcifica (non ossea) nei tessuti molli prevertebrali (o del retrofaringei), tipicamente a livello di C1-C2, così come nell’edema associato dei tessuti molli. Anche se la deposizione si verifica tipicamente anteriormente a livello del disco intervertebrale C1-C2, può essere vista anche in altri livelli vertebrali (C4-C5 o C5-C6) (Agha RA, et al. Int J Surgm 2016). Tale manifestazione può essere erroneamente confusa con altre condizioni otorinolaringoiatriche, compreso l’ascesso retrofaringeo. L’esame radiografico in proiezione laterale è solitamente diagnostico (Newmark H III, et al. Radiology 1978). La TC consente di evidenziare con maggiore sensibilità le fini calcificazioni amorfe e di confermare la sede della densità calcifica all’interno delle fibre superiori del tendine del muscolo lungo del collo (specie a livello C1-C2) (Hall FM, et al. Am J Roentgenol 1986; Newmark H III, et al. J Comput Tomogr 1986) (Figura 11).
 A
A 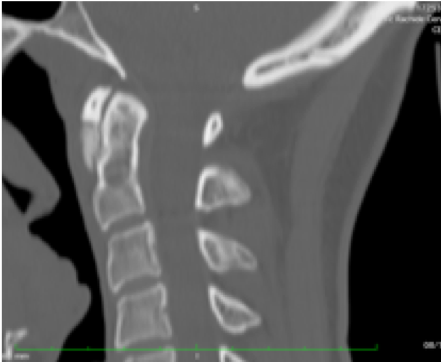 B
B
Figura 11. Esame del rachide cervicale (a) L’esame radiografico in proiezione laterale e (b) la ricostruzione MPR sul piano sagittale dell’esame TC mostrano calcificazione nello spazio prevertebrale retrofaringeo a livello di C2, al di sotto dell’arco anteriore di C1, in relazione a tendinite calcifica del muscolo lungo del collo
Frequentemente, si osservano anche modeste tumefazioni retrofaringee ed edema dei tessuti molli prevertebrali adiacenti. Occasionalmente, le fibre inferiori del tendine del muscolo lungo del collo possono essere interessate porzioni estese fino a T3. La RM evidenzia dischi e corpi vertebrali normali, e mostra, tipicamente, una raccolta fusiforme retrofaringea, senza “enhancement” contrastografico periferico (Eastwood JD, Am J Neuroradiol 1998). Il “rim di enhancement” contrastografico e/o la presenza di una linfoadenopatia suppurativa sono segni suggestivi per la presenza di un processo infettivo. La triade caratteristica più comune dei sintomi di questa malattia consiste nel dolore acuto al collo con associata marcata rigidità ed odinofagia (Park R, et al. Semin Arthritis Rheum 2009; Kim YJ, et al.Medicine (Baltimore). 2017; Omezzine SJ, et al. Joint Bone Spine 2008). L’esame obiettivo mostra la presenza di un capo atteggiato in leggera flessione con contrattura e spasmo muscolare paraspinale. Tuttavia, diversi altri sintomi possono essere associati a questa entità, come la disfagia, il limitato range di movimento del collo, l’edema faringeo e l’eritema del rinofaringe. Inoltre, gli esami di laboratorio possono mostrare un lieve aumento della velocità di eritrosedimentazione (VES), associata a piressia di grado lieve/moderata e leucocitosi (Park R, et al. Semin Arthritis Rheum 2009; Alamoudi U, et al. Int J Surg Case Rep 2017). La diagnosi differenziale tra la tendinite retrofaringea e le malattie che presentano caratteristiche cliniche simili, come la meningite, l’ascesso retrofaringeo, la neoplasia, l’ernia del disco a sede cervicale e la frattura-lussazione, è di fondamentale importanza per evitare interventi inappropriati (Harnier S, et al. Headache 2008).
– Calcificazioni che circondano il processo odontoideo. Come le calcificazioni osservate in corso di CPPD, anche quelle da HA possono depositarsi in sede periodontoidea (Feydy A, et al. Eur Radiol 2006; Bouvet JP, et al. Arthritis Rheum 1985). Sul piano clinico, la diagnosi differenziale tra HADD e CPPD risulta difficile. La calcificazione delle cartilagini articolari a carico delle articolazioni appendicolari (polsi, ginocchia, tibiotarsiche e coxo-femorali), rappresentano un segno distintivo della malattia da CPPD e possono essere evidenziate all’esame radiografico convenzionale. Tuttavia, la diagnosi definitiva della malattia da CPPD può essere posta, dimostrando la presenza dei cristalli nel liquido sinoviale. Inoltre, le calcificazioni da HA sono solitamente dense e dall’aspetto amorfo, e la deposizione dei cristalli possono scomparire nell’arco di poche settimane (Malca SA, et al. Acta Neurochir 1995). Infine, la presentazione clinica (come le lesioni distruttive precoci a carico delle vertebre coinvolte) ed il decorso relativamente lungo sono elementi a favore di una diagnosi di malattia da CPPD rispetto all’HADD.
– Calcificazioni discali. La presenza di calcificazioni discali è comune a livello della colonna cervicale (Weinberger A, et al. Semin Arthritis Rheum 1978). Tale localizzazione è associata a dolori cervicali, torcicollo o ridotto range di movimento. I dolori di tipo radicolare o i segni di compressione della radice nervosa sono rari nei bambini; tali depositi discali possono provocare dolori acuti al collo con febbre. Il dolore di solito inizia improvvisamente e persiste per 2 o 3 settimane (Bagatur AE, et al. Arch Orthop Trauma Surg 2001). L’ernia del disco è rara, ma le erniazioni posteriori possono causare compressione midollare e quelle anteriori possono determinare disfagia. D’altra parte nei pazienti asintomatici sono state rilevate lesioni a livello del rachide dorsale (Chanchairujira K, et al. Radiology 2004). Di solito si verifica la calcificazione del nucleo polposo con risparmio dell’anulus fibroso. La TC e la RM non sono generalmente necessarie, ma possono essere in grado di caratterizzare meglio la lesione.
5.3 Gotta. La gotta è una condizione di artrite infiammatoria causata dalla deposizione di cristalli di urato monosodico. L’artrite gottosa colpisce tipicamente lo scheletro appendicolare, specialmente piedi e mani. I tofi sono evidenziati in pazienti con malattia di lunga durata, ma possono anche essere una delle prime espressioni della malattia evidenziabili in soggetti dismetabolici, con iperuricemia, specialmente se associata ad insufficienza renale cronica. Il coinvolgimento del rachide nella gotta non è raro (Lumezanu E, et al. Curr Rheumatol Rep 2012). La deposizione dei cristalli di urato monosodico a livello della colonna vertebrale può essere asintomatico o oligosintomatico. Puo’ essere coinvolto, sia il tratto cervicale, che quello dorsale o lombare, indipendentemente dal coinvolgimento periferico (Cheng CW, et al. AME Case Rep 2018; Zhang T, et al. Semin Arthritis Rheum 2019). Konatalapalli et al. (Konatalapalli RM, et al. Arthritis Rheum 2010), in uno studio trasversale ha dimostrato che la gotta assiale è frequente; il 35% dei pazienti con diagnosi di gotta non controllata, mostrava un coinvolgimento del rachide con erosioni e/o tofi, evidenziabili alla TC (Konatalapalli RM, et al. Arthritis Rheum 2010). Alarcon-Segovia et al. (Alarcon-Segovia DA, et al. Am J Roentgenol Radium Ther Nucl Med 1973) ha documentato che nel 17% dei pazienti con gotta coesisteva un interessamento assiale, in particolare delle articolazioni sacroiliache (Alarcon-Segovia DA, et al. Am J Roentgenol Radium Ther Nucl Med 1973). Sebbene possa essere asintomatica, la gotta assiale tofacea è una causa riconoscita di lombalgia acuta, radicolopatia e compressione midollare. Dall’analisi della letteratura si evince che il rachide lombare è il tratto più frequentemente coinvolto, seguito da quello dorsale e cervicale (Murshid WR, et al.Br J Neurosurg 1994). Il coinvolgimento della regione atlo-epistrofica è più raro. I sintomi clinici vanno dal semplice dolore radicolare a gravi disfunzioni neurologiche, come la quadriparesi o la mielopatia (Tran A, et al. Int J Rheum Dis 2011). L’erosione ossea conseguente al deposito di cristalli di urato monosodico e le alterazioni ossee a carattere proliferativo sono le caratteristiche principali, evidenziabili all’esame radiografico convenzionale, ma non specifiche della gotta. La TC è preferibile all’esame radiografico ed alla RM per identificare l’impegno assiale, in corso di gotta. Alla RM il tofo gottoso appare come una formazione omogenea, con un segnale che va da intermedio a basso nelle sequenze T1 pesate (con la stessa intensità di segnale del muscolo), e bassa o elevata nelle immagini T2 pesate. La differenziazione dell’artrite gottosa dall’artrite infettiva o dall’osteomielite non è sempre agevole. L’edema del midollo osseo in RM è generalmente lieve nella gotta, rispetto ai casi di osteomielite concomitante. Di conseguenza, la diagnosi finale richiede spesso analisi istopatologiche o citologiche. La TC consente di evidenziare le lesioni caratteristiche della gotta assiale, quali le erosioni intra-articolari e juxta-articolari con margini sclerotici ed una densità di attenuazione maggiore rispetto al muscolo circostante a causa della deposizione di cristalli di urato monosodico (Fenton P, et al. J Bone Joint Surg Am 1995). Nel 2015, l’ACR/EULAR ha pubblicato i nuovi criteri per la classificazione della gotta, che valorizzano il ruolo della TC a doppia energia (DECT) (Bundschuh C, et al. AJR Am J Roentgenol 1988). La DECT è sempre più riconosciuta come uno strumento sensibile e specifico per l’identificazione di depositi articolari e tessutali di urato monosodico (Neogi T, et al. Ann Rheum Dis 2015; Nicolaou S, et al. Am J Roentgenol 2010). La DECT può differenziare diversi materiali in base al loro assorbimento relativo dei raggi X a diversi livelli di energia dei fotoni (Carotti M, et al. Radiol Med 2019) (Figura 12).
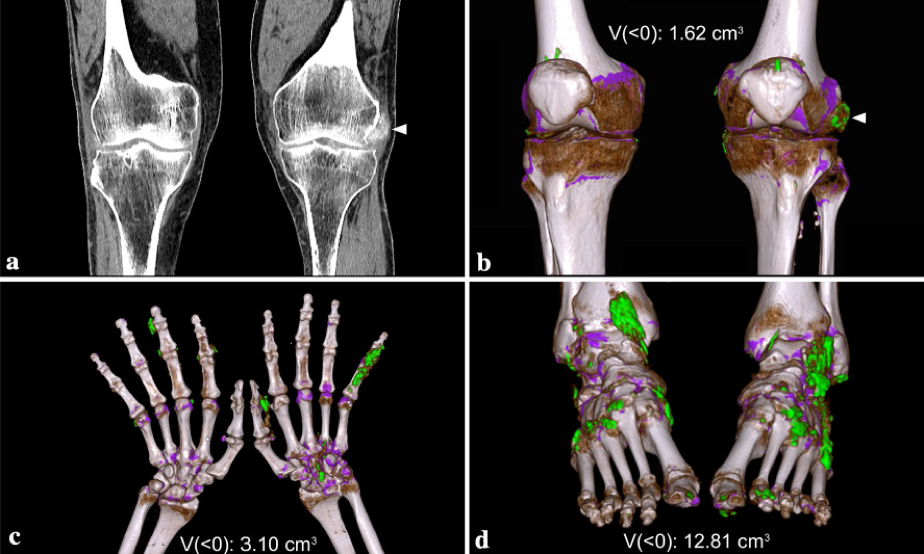
Figura 12. (a) Dual Energy CT. Immagine 70/Sn150 Mixed 0.7, MPR Coronale. Tumefazione dei tessuti molli con depositi calcifici sul versante esterno del ginocchio sinistro, a livello della doccia poplitea, in corrispondenza dell’inserzione del tendine popliteo. (b) Dual Energy CT. 70/Sn150 Mixed 0.7, Volume Rendering con color overlay per cristalli di urato monosodico. In corrispondenza delle immagini calcifiche a livello della doccia poplitea del ginocchio sinistro si dimostrano depositi di acido urico (verde). Altri depositi di acido urico sono apprezzabili a livello dei tessuti molli capsulo-sinoviali di entrambe le ginocchia, in sede meniscale e periinserzionale del tendine del muscolo quadricipite femorale, bilateralmente. Il software consente il calcolo del volume totale dei depositi di acido urico. (c) Dual Energy CT. 70/Sn150 Mixed 0.7, Volume Rendering con color overlay per cristalli di urato monosodico. La ricostruzione 3D, con codifica di colore, mostra multipli depositi di acido urico, espressi dal colore verde, a livello dei tessuti molli del carpo a destra e delle dita delle mani, bilateralmente. (d) Dual Energy CT. 70/Sn150 Mixed 0.7, Volume Rendering con color overlay per cristalli di urato monosodico. La ricostruzione 3D, con codifica di colore, mostra multipli depositi di acido urico, espressi dal colore verde, a livello dei tessuti molli della caviglia e del piede, bilateralmente.
Il coinvolgimento della giunzione cranio-cervicale nelle malattie infettive
Le infezioni si verificano per continuità o attraverso la diffusione per via ematica e sono causa di ascessi prevertebrali, intraspinali ed epidurali. Gli organismi più comunemente responsabili sono lo Staphylococcus aureus o lo Streptococcus, mentre l’infezione da Brucella o le infezioni fungine della colonna vertebrale rappresentano entità rare, seppur note. L’infezione tubercolare della colonna cervicale è una evenienza rara, ma rappresenta un grave coinvolgimento extra-polmonare. Il quadro clinico spazia da sintomi aspecifici e ad esordio insidioso, a severe complicanze neurologiche e morte, dovute all’instabilità della giunzione cranio-cervicale ed alla compressione cervico-midollare.
Artrite settica dell’articolazione atlanto-assiale
L‘artrite settica dell’articolazione atlanto-assiale rappresenta solo il 3% – 4% di tutte le infezioni spinali. La condizione è divenuta più frequente, a causa dell’invecchiamento della popolazione e dell’aumento della percentuale di pazienti immunocompromessi (Gormley W, et al. Neurosurgery 1994). Sebbene rara, la corretta diagnosi di artrite settica della porzione ato-epistrofica è importante, in quanto tale evenienza è gravata da un alto tasso di morbilità e mortalità. Numerosi casi di osteomielite del tratto cervicale superiore sono associati al’interessamento del processo odontoideo (Suchomel P, et al. Spine 2003). La diffusione alle articolazioni atlanto-assiali, con conseguente erosione del dente dell’epistrofeo, può portare all’instabilità atlanto-assiale. La sublussazione rotatoria non traumatica, su base infiammatoria, di C1 su C2, associata all’infezione della faringe e dei tessuti circostanti nei bambini è chiamata “sindrome di Grisel” (Wetzel FT, et al. Clin Orthop Relat Res 1989). Numerose condizioni patologiche, quali le otiti dell’orecchio medio, faringiti, ascessi retrofaringei, infezioni virali delle alte vie respiratorie ed interventi chirurgici del capo-collo, possono produrre un’iperemia ed una lassità patologica dei legamenti traverso ed alari dell’articolazione atlo-epistrofea; ciò è dovuto al fatto che è documentata l’esistenza di un sistema di drenaggio venoso che dalla regione faringea postero-superiore si porta ai plessi venosi epidurali cervicali. Tale sistema è in diretta connessione con il plesso venoso periodontoideo e, pertanto, può rappresentare la via di passaggio di eventuali essudati settici. I principali segni clinici che possono risultare di ausilio per differenziare la sindrome di Grisel dal torcicollo muscolare secondario ad altre condizioni patologiche, quali i tumori della fossa cranica posteriore, le neoplasie vertebrali e del midollo spinale, la malformazione di Chiari, la siringomielia, la paralisi del nervo trocleare (causa di disfunzioni visive) e le fratture di C1–C2, sono rappresentati da: (a) deviazione palpabile del processo spinoso di C2 nella stessa direzione della rotazione della testa (segno molto specifico in quanto nella rotazione normale tale deviazione avviene contro-lateralmente); (b) contrazione del muscolo sternocleidomastoideo omolaterale, quale manifestazione riflessa antalgica; (c) incapacità a ruotare la testa al di là della linea mediana nella direzione opposta a quella della lesione (Bocciolini C, et al. Acta Otorhinolaryngol Ital 2005; Sia KJ, et al. J Laryngol Otol 2012).
Anche se l’artrite settica dell’articolazione atlanto-assiale è un’entità clinica molto rara, è importante differenziare l’artrite settica dall’artrite indotta da cristalli (Tabella 4). Nella fase iniziale dell’infezione, l’esame radiografico può essere normale. I primi segni radiografici sono rappresentati da una zona di radiotrasparenza subcondrale, spesso anteriore, seguita dalla perdita di definizione delle limitanti somatiche e dalla riduzione di altezza del disco intervertebrale. Nella TC, la distruzione ossea è stata evidenziata in pazienti con artrite settica, mentre la calcificazione periodontoidea è stata osservata nella maggior parte dei casi di artrite da deposito di cristalli a livello dell’articolazione atlanto-assiale laterale. Calcificazione e sequestri sono meglio evidenziabili alla TC rispetto all’esame radiografico convenzionale. Inoltre, la biopsia TC-guidata consente di identificare il microrganismo responsabile. In RM i corpi vertebrali adiacenti alle limitanti somatiche, che appaiono mal definite, sono diffusamente ipointensi nelle sequenze spin-echo T1-pesate senza m.c.d e iperintense nelle immagini T2 pesate. Anche il disco intervertebrale presenta elevata intensità di segnale. Un versamento a livello dei processi articolari dell’articolazione atlanto-assiale è visibile nel paziente con artrite settica, ma la tumefazione dei tessuti molli o il versamento a livello delle masse laterali non sono apprezzabili nell’artrite da precipitazione di cristalli. (Kobayashi T, et al. Spine J 2014). Le immagini T1 pesate post contrastografiche evidenziano enhancement contrastografico del corpo vertebrale e del tessuto fibrovascolare alla periferia del disco intervertebrale e le aree necrotiche. La scintigrafia è in grado di mostrare eventuali focolai infettivi multipli.
Infezioni fungine
Queste infezioni della colonna vertebrale sono eventi rari (Coheh SP, et al. Mayo Clin Proc 2015; Frazier DD, et al. J Bone Joint Surg Am 2001). Le infezioni possono progredire verso un ascesso epidurale spinale, che può essere associato ad un rapido declino e ad un’elevata morbilità. I risultati clinici includono lo sviluppo di deficit neurologici con ridotta forza motoria, leucocitosi e un aumento della VES. L’infezione della giunzione atlanto-assiale è difficile da diagnosticare all’esordio, poiché i sintomi sono generalmente vaghi e variabili, e la radiografia convenzionale è scarsamente diagnostica, data la sovrapposizione dell’occipite, del seno mascellare e degli artefatti dentali (Ueda Y, et al. Spine 2009; Sasaki K, et al. J Spinal Disord Tech 2006). Di fronte ad un forte sospetto clinico trovano indicazione le moderne tecniche di imaging. La TAC e la RM, in particolare, sono di fondamentale aiuto nella diagnosi precoce di questi processi infettivi.
Spondilite tubercolare
Il coinvolgimento del rachide si verifica in circa l’1% dei pazienti con tubercolosi. L’interessamento atlanto-assiale, in particolare è estremamente raro, pari allo 0,3%-1% dei casi di spondilite tubercolare (Kanaan IU, et al. Neurol 1999). La classificazione proposta da Lifeso et al. è utilizzata per la valutazione radiologica, in cui lo stadio 1 prevede un interessamento osseo minimo con legamenti intatti e nessuna evidenza di spostamento anteriore di C1 su C2, con o senza traslocazione prossimale del dente dell’epistrofeo, lo stadio 2 considera un interessamento osseo minimo con rottura legamentosa e spostamento anteriore di C1 su C2 con o senza traslocazione prossimale dell’odontoide. Nella fase 3, è prevista una marcata distruzione ossea con obliterazione completa dell’arco anteriore di C1 (Lifeso R, J Bone Joint Surg Br 1987). La distruzione dell’osso a livello delle masse laterali dell’articolazione atlanto-assiale porta alla traslocazione verticale del dente (Chaudhary K, et al. Spine (Phila Pa 1976) 2012). Poiché il legamento trasversale ha origine dalla massa laterale dell’atlante, l’instabilità verticale è spesso associata ad uno spostamento anteriore dell’atlante. Le fratture e la distruzione del dente rappresentano lo stadio più grave della tubercolosi atlanto-assiale (Lifeso R, J Bone Joint Surg Br 1987). Chaudhary et al. hanno documentato che l’11,6% dei pazienti aveva una frattura odontoidea patologica e il 13% aveva una distruzione completa dei processi odontoidei (Chaudhary K, et al. Spine (Phila Pa 1976) 2012; Kotil K, et al. Br J Neurosurg 2004). L’instabilità acuta e le manifestazioni correlate ai problemi di compressione, come la disfagia e l’asfissia, possono provocare un grave deterioramento neurologico e la comparsa di insufficienza respiratoria (Raut AA, et al. Spine (Phila Pa 1976) 2003). La disfagia può essere il sintomo di presentazione dovuto all’effetto della compressione da parte di un voluminoso ascesso prevertebrale. Un forte sospetto clinico si ha di fronte a pazienti con rigidità del collo e debolezza del tratto cervicale superiori. La RM in questi pazienti rappresenta un metodo sensibile per la diagnosi di tubercolosi cranio-vertebrale.
Punti chiave
- La diagnosi precoce del coinvolgimento della colonna vertebrale cervicale in corso di malattie muscoloscheletriche è essenziale per evitare possibili complicazioni fatali.
- Tra le malattie infiammatorie, l’artrite reumatoide (RA) colpisce la colonna cervicale in oltre il 25% dei pazienti. L’instabilità della colonna cervicale superiore può portare a complicazioni neurologiche ed a segni clinici di insufficienza vertebro-basilare. L’interessamento della regione atlo-epistrofica è segnalato nel 6,8%-21% anche in pazienti con spondiloartrite.
- Il coinvolgimento cervicale nell’iperostosi scheletrica idiopatica diffusa (D.I.S.H), è causa riconosciuta di varie manifestazioni cliniche che coinvolgono la faringe, la laringe e l’esofago. La D.I.S.H condivide caratteristiche con la spondilite anchilosante, compresa la tendenza all’ossificazione dei legamenti e delle entesi.
- La colonna vertebrale cervicale può essere specificamente coinvolta in corso di artropatie da microcristalli come la malattia da deposito di pirofosfato diidrato di calcio, la malattia da deposito di idrossiapatite e la gotta (secondaria a deposito di cristalli di urato monosodico).
- Le infezioni spinali cervicali sono infrequenti e rappresentano il 3-4% di tutte le infezioni spinali. La loro incidenza e complessità sono aumentate a causa di diversi fattori correlati al progressivo invecchiamento della popolazione, a condizioni di immunosoppressione, alla presenza di comorbilità ecc. La tubercolosi della colonna cervicale è rara (∼0,3% dei casi).
Bibliografia
- Carotti M, Salaffi F, Di Carlo M, Sessa F, Giovagnoni A (2019) Magnetic resonance imaging of the craniovertebral junction in early rheumatoid arthritis. Skeletal Radiol 48(4):553-561.
- Zoli A, Priolo F, Galossi A et al (2000) Craniocervical junction involvnt in rheumatoid arthritis: a clinical and radiological study. J Rheumatol 27:1178–1182.
- Bundschuh C, Modic MT, Kearney F, et al (1988) Rheumatoid arthritis of the cervical spine: surface-coil MR imaging. AJR Am J Roentgenol 151:181-7.
- Salaffi F, De Angelis R, Grassi W, et al (2005) Prevalence of musculoskeletal conditions in an Italian population sample: results of a regional community-based study. The MAPPING study. Clin Exp Rheumatol 23:819–828.
- Aggarwal A, Kulshreshtha A, Chaturvedi V, Misra R (1996) Cervical spine involvement in rheumatoid arthritis: prevalence and relationship with overall disease severity. J Assoc Physicians India 44(7):468-471.
- Zikou AK, Alamanos Y, Argyropoulou MI, et al (2005) Radiological cervical spine involvement in patients with rheumatoid arthritis: a cross sectional study. J Rheumatol 32(5):801-806.
- Joaquim AF, Appenzeller S (2014) Cervical spine involvement in rheumatoid arthritis—a systematic review. Autoimmun Rev 13:1195–1202.
- Bogduk N, Major GA, Carter J (1984) Lateral subluxation of the atlas in rheumatoid arthritis: a case report and post-mortem study. Ann Rheum Dis 43:341–346.
- Nguyen HV, Ludwig SC, Silber J et al (2004) Rheumatoid arthritis of the cervical spine. Spine J 4:329–334.
- Reiter MF, oden SD (1998) Inflammatory disorders of the cervical spine. Spine 23:2755-2766
- Scott DL, Coulton BL, Propert AJ (1986) Long term progression of joint damage in rheumatoid arthritis. Ann Rheum Dis 45:373-378.
- Jansen LMA, van der Horst-Bruinsma E, van Schaardenburg D, Bezemer PD, Dijkamns BAC (2001) Predictors of radiographic joint damage in patients with early rheumatoid arthritis. Ann Rheum Dis 60:924-927.
- Pellici PM, Ranawat CS, Tsairis P, Bryan WJ (1981) A prospective study of the progression of rheumatoid arthritis of the cervical spine. J Bone Joint Surg Am 63:342–350.
- Fujiwara K, Owaki H, Fujimoto M, Yonenobu K, Ochi T (2000) A long-term follow-up study of cervical lesions in rheumatoid arthritis. J Spinal Disord 13:519-526.
- Sunahara N, Matsunaga S, Mori T, Ijiri K, Sakou T (1997) Clinical course of conservatively managed rheumatoid arthritis patients with myelopathy. Spine 22:2603-2607.
- Casey AT, Crockard HA, Stevens J (1997) Vertical translocation. Part II. Outcomes after surgical treatment of rheumatoid cervical myelopathy. J Neurosurg 87:863-869.
- Reichel H, Liebhaber A, Babinsky K, Keysser G (2002) Radiological changes in the cervical spine in rheumatoid arthritis — prognostic factors obtained by a cross-sectional study. Z Rheumatol 61(6):710-717.
- Neva MH, Isomaki P, Hannonen P, Kauppi M, Krishnan E, Sokka T (2003) Early and extensive erosiveness in peripheral joints predicts atlantoaxial subluxations in patients with rheumatoid arthritis, Arthritis Rheum 48:1808-1813.
- Paimela L, Laasonen L, Kankaanpaa E, Leirisalo-Repo M (1997) Progression of cervical spine changes in patients with early rheumatoid arthritis, J Rheumatol 24:1280-1284.
- Reichel H, Liebhaber A, Babinsky K, Keysser G (2002) Radiological changes in the cervical spine in rheumatoid arthritis—prognostic factors obtained by a cross-sectional study, Z Rheumatol 61:710-717.
- Scott DL, Pugner K, Kaarela K et al (2000) The links between joint damage and disability in rheumatoid arthritis. Rheumatology (Oxford) 39(2):122-132.
- Lindqvist E, Saxne T, Geborek P, Eberhardt K (2002) Ten year outcome in a cohort of patients with early rheumatoid arthritis: health status, disease process, and damage. Ann Rheum Dis 61(12):1055-1059.
- Ahn JK, Hwang JW, Oh JM et al (2011) Risk factors for development and progression of atlantoaxial subluxation in Korean patients with rheumatoid arthritis. Rheumatol Int 31:1363-8.
- Conaghan PG, O’Connor P, McGonagle D et al (2003) Elucidation of the relationship between synovitis and bone damage: a randomized magnetic resonance imaging study of individual joints in patients with early rheumatoid arthritis. Arthritis Rheum 48:64-71.
- McQueen FM, Benton N, Perry et al (2003) Bone edema scored on magnetic resonance imaging scans of the dominant carpus at presentation predicts radiographic joint damage of the hands and feet six years later in patients with rheumatoid arthritis. Arthritis Rheum 48:1814-1827.
- Schwarz-Eywill M, Friedberg R, Stosslein F, Unger L, Nusslein H (2005) Rheumatoid arthritis at the cervical spine—an underestimated problem. Dtsch Med Wochenschr 130:1866–1870.
- Magarelli N, Simone F, Amelia R et al (2010) MR imaging of atlantoaxial joint in early rheumatoid arthritis. Radiol Med 115(7):1111-1120.
- Ramos-Remus C, Gomez-Vargas A, Guzman-Guzman JL et al (1995) Frequency ofatlantoaxial subluxation and neurologic involvement in patients with ankylosing spondylitis. J Rheumatol 22:2120–2125.
- Hamdi W, Alaya Z, Ghannouchi MM, Haouel M, Kchir MM (2012) Associated risk factors with worse functional prognosis and hip replacement surgery in ankylosing spondylitis. Joint Bone Spine 79(1):94–96.
- Slobodin G, Shpigelman A, Dawood H et al (2015) Craniocervical junction involvement in ankylosing spondylitis. Eur Spine J 24(12):2986–90.
- El Maghraoui A, Bensabbah R, Bahiri R, Bezza A, Guedira N, Hajjaj-Hassouni N (2003) Cervical spine involvement in ankylosing spondylitis. Clin Rheumatol 22:94-98.
- Liu J, Zhu L, Jiang E, Zou S, Xu G (2019) Ankylosing spondylitis manifested by extensive cervical Erosions with spontaneous anterior atlantoaxial subluxation. World Neurosurg 122:583-589.
- Benmansour A, Toussirot E, Wendling D (1996) Upper cervical spine involvement in ankylosing spondylitis. Rachis 8(4):181–192.
- Chandran V, Barrett J, Schentag CT, Farewell VT, Gladman DD (2009) Axial psoriatic arthritis: update on a longterm prospective study. J Rheumatol 36: 2744-2750.
- Blau RH, Kaufman RL (1987) Erosive and subluxing cervical spine disease in patients with psoriatic arthritis. J Rheumatol 14: 111-117.
- Laiho K, Kauppi M (2002) The cervical spine in patients with psoriatic arthritis. Ann Rheum Dis 61(7):650-652.
- Jeannou J, Goupille P, Avimadje MA, Zerkak D, Valat JP, Fouquet B (1999) Cervical spine involvement in psoriatic arthritis. Rev Rhum Engl Ed 66(12):695-700.
- Jenkinson T, Armas J, Evison G, Cohen M, Lovell C, McHugh NJ (1994) The cervical spine in psoriatic arthritis: a clinical and radiological study. Br J Rheumatol 33(3):255-259.
- Bobek D, Babić-Naglić D, Potocki K, Kern J, Badovinac O, Curković B (2007) The cervical spine involvement in patients with psoriatic arthritis. Reumatizam 54(1):12-15.
- Salvarani C, Macchioni P, Cremonesi T et al (1992) The cervical spine in patients with psoriatic arthritis: a clinical, radiological and immunogenetic study. Ann Rheum Dis 51:73–77.
- Mader R, Verlaan JJ, Eshed I et al (2017) Diffuse idiopathic skeletal hyperostosis (DISH): where we are now and where to go next. RMD Open 21;3(1):e000472.
- Kagotani R, Yoshida M, Muraki S et al (2015) Prevalence of diffuse idiopathic skeletal hyperostosis (DISH) of the whole spine and its association with lumbar spondylosis and knee osteoarthritis: the ROAD study. J Bone Miner Metab 33(2):221–229.
- Hiyama A, Katoh H, Sakai D, Sato M, Tanaka M, Watanabe M (2018) Prevalence ofdiffuse idiopathic skeletal hyperostosis (DISH) assessed with whole-spine computed tomography in 1479 subjects. BMC Musculoskelet Disord 30;19(1):178.
- Resnick D, Niwayama G (1976) Radiographic and pathologic features of spinal involvement in diffuse idiopathic skeletal hyperostosis (DISH) Radiology 119:559–568.
- Forestier J, Lagier R (1971) Ankylosing hyperostosis of the spine. Clin Orthop Relat Res 74:65–81.
- Utsinger PD (1985) Diffuse idiopathic skeletal hyperostosis. Clin Rheum Dis 11:325–355.
- Leibushor N, Slonimsky E, Aharoni D et al (2017) CT abnormalities in the sacroiliac joints of patients with diffuse idiopathic skeletal hyperostosis. AJR Am J Roentgenol 208:834–837.
- Slonimsky E, Leibushor N, Aharoni D, et al (2016) Pelvic enthesopathy on CT is significantly more prevalent in patients with diffuse idiopathic skeletal hyperostosis (DISH) compared with matched control patients. Clin Rheumatol 35:1823–1827.
- Olivieri I, D’Angelo S, Palazzi C, Padula A, Mader R, Khan MA (2009) Diffuse idiopathic skeletal hyperostosis: differentiation from ankylosing spondylitis. Curr Rheumatol Rep 11(5):321-328.
- Vengust R., Mihalic R., Turel M (2010) Two different causes of acute respiratory failure in a patient with diffuse idiopathic skeletal hyperostosis and ankylosed cervical spine. Eur Spine J 19(suppl 2):S130–S134.
- Gosavi K, Dey P, Swami S (2018) Airway Management in Case of Diffuse Idiopathic Skeletal Hyperostosis. Asian J Neurosurg 13(4):1260-1263.
- Varsak YK, Eryilmaz MA, Arbağ H (2014) Dysphagia and airway obstruction due to large cervical osteophyte in a patient with ankylosing spondylitis. J Craniofac Surg 25(4):1402-1403.
- Masiero S, Padoan E, Bazzi M, Ponzoni A (2010) Dysphagia due to diffuse idiopathic skeletal hyperostosis: an analysis of five cases. Rheumatol Int 30:681–685.
- Carlson ML, Archibald DJ, Graner DE, Kasperbauer JL (2011) Surgical management of dysphagia and airway obstruction in patients with prominent ventral cervical osteophytes. Dysphagia 26:34–40.
- Giger R, Dulguerov P, Payer M (2006) Anterior cervical osteophytes causing dysphagia and dyspnea: An uncommon entity revisited. Dysphagia 21:259–263.
- Verlaan JJ, Boswijk P.F, de Ru J.A, Dhert WJ, Oner FC (2011) Diffuse idiopathic skeletal hyperostosis of the cervical spine: an underestimated cause of dysphagia and airway obstruction. Spine J 11:1058–1067.
- McAfee PC, Regan JJ, Bohlman HH (1987) Cervical cord compression from ossification of the posterior longitudinal ligament in non orientals. J Bone Joint Surg Br 69:569–575.
- Aydin E, Akdogan V, Akkuzu B, Kirbaş I, Ozgirgin ON (2006) Six cases of forestier syndrome, a rare cause of dysphagia. Acta Otolaryngol 126:775–778.
- Cammisa M, de Serio A, Guglielmi G (1998) Diffuse idiopathic skeletal hyperostosis. Eur J Radiol 27:S7–S11.
- Feydy A, Lioté F, Carlier R, Chevrot A, Drapé JL (2006) Cervical spine and crystal-associated diseases: imaging findings. Eur Radiol 16(2):459-468.
- Dieppe PA, Alexander GJ, Jones H et al (1982) Pyrophosphate arthropathy: a clinical and radiological study of 105 cases. Ann Rheum Dis 41: 371–376.
- Baba H, Maezawa Y, Kawahara N, Omita K, Furusawa N, Imura S (1993) Calcium crystal deposition in the ligamentum flavum of the cervical spine. Spine 18:2174–2181.
- Bouvet JP, Le Parc JM, Michalski B, Benlahrache C, Auquier L (1985) Acute neck pain due to calcifications surrounding the odontoid process: the crowned dens syndrome. Arthritis Rheum 28:1417–1420.
- Salaffi F, Carotti M, Guglielmi G, Passarini G, Grassi W (2008) The crowned dens syndrome as a cause of neck pain: clinical and computed tomography study in patients with calcium pyrophosphate dihydrate deposition disease. Clin Exp Rheumatol 26(6):1040-1046.
- Aouba A, Bodaghi-Vuillemin V, Mutshler C, De Brandt M (2004) Crowned dens syndrome misdiagnosed as polymyalgia rheumatica, giant cell arteritis, meningitis or spondylitis: an analysis of eight cases. Rheumatology 43:1508-12.
- Constantin A, Marin F, Bon E, Fedele M, Lagarrigue B, Bouteiller G (1996) Calcification of the transverse ligament of the atlas in chondrocalcinosis: computed tomography study. Ann Rheum Dis 55:137–139.
- Milz S, Schluter T, Putz R, Moriggl B, Ralphs JR, Benjamin M (2001) Fibrocartilage in the transverse ligament of the human atlas. Spine 26:1765-1771.
- Kakitsubada Y, Boutin RD, Theodorou DJ et al (2000) Calcium pyrophosphate dehydrate crystal deposition in and around the atlantoaxial joint: association with type 2 odontoid fractures in nine patients. Radiology 216:213-219.
- Garcia GM, McCord GC, Kumar R (2003) Hydroxyapatite crystal deposition disease. Semin Musculoskelet Radiol 7(3):187-193.
- Zibis AH, Giannis D, Malizos KN et al (2013) Acute calcific tendinitis of the longus colli muscle: case report and review of the literature. Eur Spine 22(suppl 3):S434–S348.
- Levy Z, Carroll J, Farley H (2012) Benign nuchal rigidity: the emergency department evaluation of acute prevertebral calcific tendonitis. West J Emerg Med13:114–116.
- Wakabayashi Y, Hori Y, Kondoh Y, et al (2012) Acute calcific prevertebral tendonitis mimicking tension-type headache. Neurol Med Chir (Tokyo) 52:631–633.
- Agha RA, Fowler AJ, Saetta A, Barai I, Rajmohan S, Orgill DP, the SCARE group (2016) The SCARE statement: consensus-based surgical case report guidelines. Int J Surgm 34:180–186.
- Newmark H III, Forrester DM, Brown JC, Robinson A, Oiken SM, Bledsoe R (1978) Calcific tendinitis of the neck. Radiology 128:355–358.
- Hall FM, Docken WP, Curtis HW (1986) Calcific tendinitis of the longus coli: diagnosis by CT. Am J Roentgenol 147:742–743.
- Newmark H III, Blackford D, Roberts D, Chakmakian V, Adler J (1986) Computed tomography of acute cervical spine tendinitis. J Comput Tomogr 10:373–375.
- Eastwood JD, Hudgins PA, Malone D (1998) Retropharyngeal effusion in acute calcific prevertebral tendinitis: diagnosis with CT and MR imaging. Am J Neuroradiol 19:1789–1792.
- Park R, Halpert DE, Baer A, Kunar D, Holt PA (2009) Retropharyngeal calcific tendinitis: case report and review of the literature. Semin Arthritis Rheum 39(6):504–509.
- Kim YJ, Park JY, Choi KY, Moon BJ, Lee JK (2017) Case reports about an overlooked cause of neck pain: calcific tendinitis of the longus colli: Case reports. Medicine (Baltimore). 96(46):e8343.
- Omezzine SJ, Hafsa C, Lahmar I, et al (2008) Calcific tendinitis of the longus colli: diagnosis by CT. Joint Bone Spine 75:90–91.
- Alamoudi U, Al-Sayed AA, AlSallumi Y, Rigby MH et al (2017) Acute calcific tendinitis of the longus colli muscle masquerading as a retropharyngeal abscess: A case report and review of the literature. Int J Surg Case Rep 41:343-346.
- Harnier S, Kuhn J, Harzheim A, Bewermeyer H, Limmroth V (2008) Retropharyngeal tendinitis: a rare differential diagnosis of severe headaches and neck pain. Headache 48(1):158–161.
- Malca SA, Roche PH, Pellet W, Combalbert A (1995) Crowned dens syndrome: a manifestation of hydroxy-apatite rheumatism. Acta Neurochir 135:126-130.
- Weinberger A, Myers AR (1978) Intervertebral disc calcification in adults: a review. Semin Arthritis Rheum 8(1):69-75.
- Bagatur AE, Zorer G, Centel T (2001) Natural history of paediatric intervertebral disc calcification. Arch Orthop Trauma Surg 121:601–603.
- Chanchairujira K, Chung CB, Kim JY et al (2004) Intervertebral disk calcification of the spine in an elderly population: radiographic prevalence, location, and distribution and correlation with spinal degeneration. Radiology 230:499–503.
- Lumezanu E, Konatalapalli R, Weinstein A (2012) Axial (spinal) gout. Curr Rheumatol Rep. 14(2):161-164.
- Cheng CW, Nguyen QT, Zhou H (2018) Tophaceous gout of the cervical and thoracic spine with concomitant epidural infection. AME Case Rep 10;2:35.
- Zhang T, Yang F, Li J, Pan Z (2019) Gout of the axial joint-A patient level systemic review. Semin Arthritis Rheum 48(4):649-657.
- Konatalapalli RM, Lumezanu EM, Jelinek JS, et al (2010) A prospective study of correlates of axial gout. Arthritis Rheum 62:S869.
- Alarcon-Segovia DA, Cetina JA, Diaz-Jouanen E (1973) Sarcroilaic joints in primary gout. Clinical and roentgenographic study of 143 patients. Am J Roentgenol Radium Ther Nucl Med 118:438–43.
- Murshid WR, Moss TH, Ettles DF, Cummins BH (1994) Tophaceous gout of the spine causing spinal cord compression. Br J Neurosurg 8:751–754.
- Tran A, Prentice D, Chan M (2011) Tophaceous gout of the odontoid process causing glossopharyngeal, vagus, and hypoglossal nerve palsies. Int J Rheum Dis 14(1):105-108.
- Fenton P, Young S, Prutis K (1995) Gout of the spine. Two case reports and a review of the literature. J Bone Joint Surg Am 77:767–771.
- Neogi T, Jansen TL, Dalbeth N, Fransen J, Schumacher HR, Berendsen D, et al. (2015) 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 74(10):1789-98.
- Nicolaou S, Yong-Hing CJ, Galea-Soler S et al (2010) Dual-energy CT as a potential new diagnostic tool in the management of gout in the acute setting. Am J Roentgenol 194:1072–1078.
- Carotti M, Salaffi F, Beci G, Giovagnoni A (2019) The application of dual-energy computed tomography in the diagnosis of musculoskeletal disorders: a review of current concepts and applications. Radiol Med doi: 10.1007/s11547-019-01015-x.
- Gormley W, Rock J (1994) Spontaneous atlantoaxial osteomyelitis: no longer a rare case? Case report. Neurosurgery 35:132–136.
- Suchomel P, Buchvald P, Barsa P, Lukas R, Soukup T (2003) Pyogenic osteomyelitis of the odontoid process: single stage decompression and fusion. Spine 28:E239–244.
- Wetzel FT, La Rocca H (1989) Grisel’s syndrome. Clin Orthop Relat Res 240:141–152.
- Bocciolini C, Dall’Olio D, Cunsolo E, Cavazzuti PP, Laudadio P (2005) Grisel’s syndrome: a rare complication following adenoidectomy. Acta Otorhinolaryngol Ital 25:245–249.
- Sia KJ, Tang IP, Kong CK, Nasriah A (2012) Grisel’s syndrome: a rare complication of tonsillectomy. J Laryngol Otol 126(5):529-531.
- Kobayashi T, Miyakoshi N, Konno N, Abe E, Ishikawa Y, Shimada Y (2014) Acute neck pain caused by arthritis of the lateral atlantoaxial joint. Spine J 14:1909–1913.
- Coheh SP (2015) Epidemiology, diagnosis, and treatment of neck pain. Mayo Clin Proc 90(2): 284-299.
- Frazier DD, Campbell DR, Garvey TA, Wiesel S, Bohlman HH, Eismont FJ (2001) Fungal infections of the spine. Report of eleven patients with long-term follow-up. J Bone Joint Surg Am 83:560–565.
- Ueda Y, Kawahara N, Murakami H, Matsui T, Tomita K (2009) Pyogenic osteomyelitis of the atlas: a case report. Spine (Phila Pa 1976) 34:E342–345.
- Sasaki K, Nabeshima Y, Ozaki A et al (2006) Septic arthritis of the atlantoaxial joint: case report. J Spinal Disord Tech 19:612–615.
- Kanaan IU, Ellis M, Safi T, Al Kawi MZ, Coates R (1999) Craniocervical junction tuberculosis: A rare but dangerous disease. Surg Neurol 51:21–25.
- Lifeso R (1987) Atlanto‑axial tuberculosis in adults. J Bone Joint Surg Br 69:183‑187.
- Chaudhary K, Potdar P, Bapat M, Rathod A, Laheri V (2012) Structural odontoid lesions in craniovertebral tuberculosis: a review of 15 cases. Spine (Phila Pa 1976) 15;37(14):E836-843.
- Kotil K, Dalbayrak S, Alan S (2004) Craniovertebral junction Pott’s disease. Br J Neurosurg 18: 49–55.
- Raut AA, Narlawar RS, Nagar A et al (2003) An unusual case of CV junction tuberculosis presenting with quadriplegia 28:E309.
